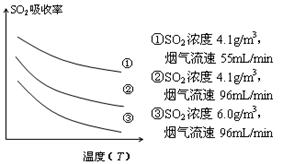
题目内容
已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有
的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| 1 |
| 2 |
| A.1.1mol?L-1 | B.1.5mol?L-1 | C.1.2mol?L-1 | D.1.0mol?L-1 |
已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为
=0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有
的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=
n(I-)=
cV=0.1cmol,
反应完成后溶液中有
的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=
×
n(Fe2+)=
cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol
解得:c=1.2mol/L,
故选C.
| 3.36L |
| 22.4L/mol |
| 1 |
| 2 |
Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=
| 1 |
| 2 |
| 1 |
| 2 |
反应完成后溶液中有
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
解得:c=1.2mol/L,
故选C.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- +H
+H +H2O=Al(OH)3↓
+H2O=Al(OH)3↓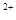 +2H2O+2Cl2↑
+2H2O+2Cl2↑ 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: