题目内容
某种铁的氧化物样品,用140mL 5mol/L盐酸恰好完全溶解,所得溶液通入标准状况下0.56L氯气,此时Fe2+全部转化为Fe3+,该样品可能为
- A.Fe2O3
- B.Fe3O4
- C.Fe4O5
- D.Fe5O7
D
【解析】铁的氧化物依题意最终形成了H2O和FeCl3.根据原子守恒,反应前后H都应为0.14×5=0.7mol,所以H2O为0.35mol,O为0.35mol;反应过程中Cl-为0.7+(0.56/22.4)×2=0.75mol,根据离子守恒Fe3+应为0.75/3=0.25mol,即氧化物中n(Fe)∶n(O)=0.25∶0.35=5∶7,因此,化学式为Fe5O7.
【拓展延伸】在化学计算中,用“守恒法”可能达到事半功倍的效果,“守恒法”包括:电子守恒、原子守恒、电荷守恒、质量守恒、物质的量守恒、体积守恒.
【解析】铁的氧化物依题意最终形成了H2O和FeCl3.根据原子守恒,反应前后H都应为0.14×5=0.7mol,所以H2O为0.35mol,O为0.35mol;反应过程中Cl-为0.7+(0.56/22.4)×2=0.75mol,根据离子守恒Fe3+应为0.75/3=0.25mol,即氧化物中n(Fe)∶n(O)=0.25∶0.35=5∶7,因此,化学式为Fe5O7.
【拓展延伸】在化学计算中,用“守恒法”可能达到事半功倍的效果,“守恒法”包括:电子守恒、原子守恒、电荷守恒、质量守恒、物质的量守恒、体积守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
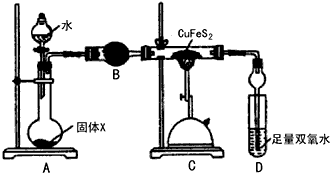
浓硫酸与乙二酸(H2C2O4)在加热条件下反应的化学方程式为:H2C2O4 CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
 CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。

Ⅰ.(1)D装置的作用是________。
(2)E装置的作用是________。
(3)I装置的作用是________。
Ⅱ.甲同学用上述装置,取不同质量的铁的氧化物进行实验。所得实验数据如下:
|
实验序号 |
铁的氧化物质量/g |
生成铁的质量/g |
|
1 |
4.00 |
2.81 |
|
2 |
8.00 |
7.62 |
|
3 |
10.00 |
7.01 |
|
4 |
12.00 |
8.42 |
|
5 |
14.00 |
9.81 |
|
6 |
16.00 |
12.22 |
|
7 |
18.00 |
12.63 |
|
8 |
20.00 |
14.03 |
(1)如果以y轴表示生成铁的质量,x轴表示铁的氧化物质量,请用铅笔在上面坐标图上依次找出相应的实验数据的点。

(2)从坐标图上可以看出甲进行第二次实验时,所得数据不十分可靠,故舍去。请分析造成此种结果的原因主要可能是________或________。
(3)请利用上图回答。第二次实验时生成的铁的质量约为________g(小数点后保留一位)。
(4)如果另一位同学乙取了25 g铁的氧化物样品而来不及做实验,但根据上述图示,可以求出所生成的铁的重量为________(小数点后保留一位)。将你所用方法在上图中画出。
(5)同学丙看了甲、乙两同学所做的方法后认为:只要认真进行两次实验,就以回答上述问题。请用甲同学的两组实验数据,用数学方法写出丙同学的分析过程。
(6)丁同学看了上述分析过程后,认为只要一组准确的实验数据就能解决问题。他是怎样分析的?Si+O2=SiO2