题目内容
在一定的条件下,当A.SO2(g)+O2(g)![]() SO3(g) ΔΗ=-98.3 kJ·mol-1
SO3(g) ΔΗ=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)![]() 2SO3(l) ΔΗ=-196.6 kJ·mol-1
2SO3(l) ΔΗ=-196.6 kJ·mol-1
C.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔΗ=-98.3 kJ·mol-1
SO3(g) ΔΗ=-98.3 kJ·mol-1
D.2SO2(g)+O2(g)![]() 2SO3(g) ΔΗ=+196.6 kJ·mol-1
2SO3(g) ΔΗ=+196.6 kJ·mol-1
解析:此题旨在考查ΔΗ与物质的量的关系,及书写热化学反应方程式的注意事项。1 mol SO2完全氧化为SO3气体时放出热量为98.3 kJ·mol-1,即ΔΗ为负值。
答案:C

练习册系列答案
相关题目
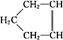 可简写为
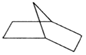
可简写为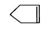 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为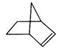
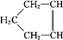 可简写为
可简写为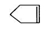 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为