题目内容
将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O (g)+CO(g) H2 (g)+CO2(g)
H2 (g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2.在其他条件不变的情况下,若将1molCO和2molH2O充入反应器中,则反应达平衡后,混合气体中CO2的体积分数可能为( )
A.

B.

C.

D.

【答案】分析:利用达到平衡时,发现有50%的CO转化为CO2,根据化学平衡的三段法计算出平衡时的量,然后计算混合气体中CO2的体积分数;
若将1molCO和2molH2O充入反应器,增大了水的量,将促进CO的转化,假设转化率为100%来计算混合气体中CO2的体积分数;
根据CO的转化率的范围来确定CO2的体积分数的范围即可判断答案.
解答:解:由到平衡时,发现有50%的CO转化为CO2,则
H2O (g)+CO(g) H2 (g)+CO2(g)
H2 (g)+CO2(g)
开始1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
则CO2的体积分数为 =
= ,
,
若将1molCO和2molH2O充入反应器,CO的转化率为100%,则
H2O (g)+CO(g) H2 (g)+CO2(g)
H2 (g)+CO2(g)
开始2 1 0 0
转化 1 1 1 1
平衡 1 0 1 1
CO2的体积分数为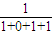 =
= ,
,
即CO的转化率介于50%--100%之间,所以CO2的体积分数介于 --
-- 之间,
之间,
 介于
介于 --
-- 之间,故选C.
之间,故选C.
点评:本题考查学生利用化学平衡的三段法计算,明确转化率及体积分数的计算方法及利用转化率确定CO2的体积分数的范围是解答本题的关键.
若将1molCO和2molH2O充入反应器,增大了水的量,将促进CO的转化,假设转化率为100%来计算混合气体中CO2的体积分数;
根据CO的转化率的范围来确定CO2的体积分数的范围即可判断答案.
解答:解:由到平衡时,发现有50%的CO转化为CO2,则
H2O (g)+CO(g)
 H2 (g)+CO2(g)
H2 (g)+CO2(g)开始1 1 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
则CO2的体积分数为
 =
= ,
,若将1molCO和2molH2O充入反应器,CO的转化率为100%,则
H2O (g)+CO(g)
 H2 (g)+CO2(g)
H2 (g)+CO2(g)开始2 1 0 0
转化 1 1 1 1
平衡 1 0 1 1
CO2的体积分数为
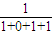 =
= ,
,即CO的转化率介于50%--100%之间,所以CO2的体积分数介于
 --
-- 之间,
之间, 介于
介于 --
-- 之间,故选C.
之间,故选C.点评:本题考查学生利用化学平衡的三段法计算,明确转化率及体积分数的计算方法及利用转化率确定CO2的体积分数的范围是解答本题的关键.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目