题目内容
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3,和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。

请回答:
(1)各组反应开始时_____________,装置中的气球体积先变大,该装置中反应的离子方程式是_________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 | 分析原因 | |
| 第①组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol / L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)= V乙(CO2) |
| 第②组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol / L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第③组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol / L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
(1) 甲; HCO3-+H+ =H2O+CO2↑
(2)
| 试剂用量 | 实验现象 | 分析原因 | |
| ② | 甲、乙盐酸均过量 n(NaHCO3)>n(Na2CO3) V甲(CO2)>V乙(CO2) | ||
| ③ | 甲、乙盐酸均不足量 消耗的n(NaHCO3)>n(Na2CO3) V甲(CO2)>V乙(CO2) | ||
|
|
解析:
Na2CO3与稀盐酸的反应时,先生成NaHCO3,然后NaHCO3再与稀盐酸反应生成NaCl、H2O、CO2。因此,NaHCO3与稀盐酸反应的速率快。据此第(2)题也能顺利解答。须特别说明的是:0.6 g Na2CO3与3 mL 2 mol / L盐酸反应时,Na2CO3过量,过量的Na2CO3溶液与生成的CO2气体慢慢反应,因此,出现了“片刻后,乙中气球又缩小”的现象。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
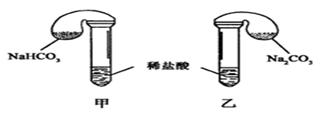
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
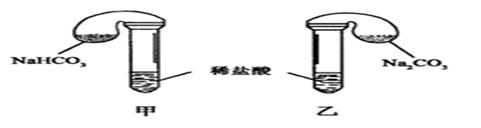
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
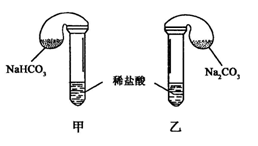
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
组 数 |
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
|
① |
0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
|
② |
0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
|
③ |
0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
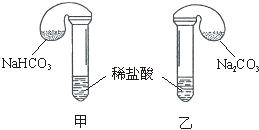
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 |
|
第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 |
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |