题目内容
某澄清溶液中可能含有下列离子:Na+、NH4+、Fe2+、Fe3+、Ba2+、SO42-、HCO3-、Cl-.对其进行如下实验:
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀.
下列关于该溶液的说法中正确的是( )
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀.
下列关于该溶液的说法中正确的是( )
| A、该溶液中一定不存在Ba2+和HCO3- | B、取③中滤液加入KSCN,溶液显红色,则原溶液中一定有Fe3+ | C、该溶液中一定存在SO42-和Cl- | D、另取该溶液加少贵NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原 溶液中一定不存在NH4+ |
分析:溶液澄清说明离子可以大量共存,
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色,说明溶液呈酸性,含有大量的H+,则HCO3-一定不存在;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,白色沉淀为BaSO4,溶液中含有SO42-,则溶液一定没有Ba2+;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀,该沉淀是AgCl,由于②中引入C1-,不能证明原溶液含有C1-;
取③中滤液加入KSCN,溶液显红色,溶液只含有Fe3+,但③中加入酸化硝酸银溶液,有强氧化性,原溶液中可能含有Fe2+或Fe3+或Fe2+、Fe3+;
原溶液为酸性,另取该溶液加少量NaOH溶液后,可能为酸性,微热,不能生成氨气.
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色,说明溶液呈酸性,含有大量的H+,则HCO3-一定不存在;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,白色沉淀为BaSO4,溶液中含有SO42-,则溶液一定没有Ba2+;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀,该沉淀是AgCl,由于②中引入C1-,不能证明原溶液含有C1-;
取③中滤液加入KSCN,溶液显红色,溶液只含有Fe3+,但③中加入酸化硝酸银溶液,有强氧化性,原溶液中可能含有Fe2+或Fe3+或Fe2+、Fe3+;
原溶液为酸性,另取该溶液加少量NaOH溶液后,可能为酸性,微热,不能生成氨气.
解答:解:A.由属于①,试纸显红色,说明溶液呈酸性,含有大量的H+,则HCO3-一定不存在.由实验②可知,白色沉淀只能为BaSO4,溶液中含有SO42-,则溶液一定没有Ba2+,故A正确;
B.取③中滤液加入KSCN,溶液显红色,溶液只含有Fe3+,但③中加入酸化硝酸银溶液,有强氧化性,原溶液中可能含有Fe2+或Fe3+或Fe2+、Fe3+,故B错误;
C.由实验②可知,溶液中含有SO42-,由实验③可知,该沉淀是AgCl,由于②中引入C1-,不能证明原溶液含有C1-,故C错误;
D.原溶液为酸性,另取该溶液加少量NaOH溶液,氢氧化钠不足,溶液可能为酸性,微热,不能生成氨气,试管口的湿润红色石蕊试纸不变蓝,不能说明原溶液中是否存在NH4+,故D错误;
故选A.
B.取③中滤液加入KSCN,溶液显红色,溶液只含有Fe3+,但③中加入酸化硝酸银溶液,有强氧化性,原溶液中可能含有Fe2+或Fe3+或Fe2+、Fe3+,故B错误;
C.由实验②可知,溶液中含有SO42-,由实验③可知,该沉淀是AgCl,由于②中引入C1-,不能证明原溶液含有C1-,故C错误;
D.原溶液为酸性,另取该溶液加少量NaOH溶液,氢氧化钠不足,溶液可能为酸性,微热,不能生成氨气,试管口的湿润红色石蕊试纸不变蓝,不能说明原溶液中是否存在NH4+,故D错误;
故选A.
点评:本题考查离子的检验和推断,题目难度中等,注意把握离子反应的实验现象以及离子的检验的实验操作方法.

练习册系列答案
相关题目
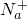 、
、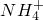 、Fe2+、Fe3+、Ba2+、
、Fe2+、Fe3+、Ba2+、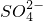 、
、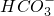 、Cl-.对其进行如下实验:
、Cl-.对其进行如下实验: