题目内容
某天然碱(纯净物)可看作是由CO2和NaOH反应后的产物所组成,其化学式为xNa2CO3·yNaHCO3·zH2O。某化学兴趣小组为确定x、y、z的值进行如下实验:称取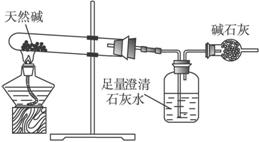
装置Ⅰ
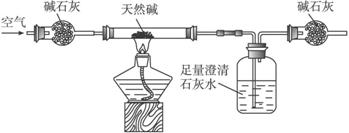
装置Ⅱ
(1)按照上述实验过程,该化学兴趣小组至少使用________次天平。
(2)将天然碱样品加热,冷却至室温,称量其质量为b
(3)你认为选择____________(填“装置Ⅰ”或“装置Ⅱ”)进行实验为佳。选择的理由是___________________________________________________________________。
(4)有一学生在加热过程中对剩余固体进行多次称重(处理数据时已经减去仪器质量),并描出如下图的曲线;
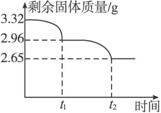
①写出t1→t2反应的化学方程式:________________________________________________。
②通过上述曲线确定天然碱样品的化学式:________________________________________。
(1)5
(2)继续加热
(3)装置Ⅱ 选用装置Ⅰ会有少量CO2仍留在试管中造成误差大
(4)①2NaHCO3![]() Na2CO3+H2O+CO2↑〔或xNa2CO3·yNaHCO3
Na2CO3+H2O+CO2↑〔或xNa2CO3·yNaHCO3![]() (x+
(x+![]() )Na2CO3+
)Na2CO3+![]() H2O+
H2O+![]() CO2↑〕
CO2↑〕
②2Na2CO3· NaHCO3·2H2O
解析:本题用实验的方法确定CO2与H2O反应产物的化学式的确定。第(1)问应称五次质量,分别是称样品的质量、样品和试管的总质量、加热后的质量、再加热后的质量、过滤后沉淀的质量。第(2)问,只有当两者之间的差值小于

 阅读快车系列答案
阅读快车系列答案某天然碱(纯净物)可看作由C02和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生C02的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸溶液的体积(mL) | 30 | 30 | 30 | 30 |
样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(1) 另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(2)已知Na2CO3和HCl溶液的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+CO2↑+H2O
由上表第Ⅳ组数据可以确定所用的HCl溶液的浓度为 ____mol?L-1。
(3)依据上表的数据以及天然碱的化学式,讨论并确定上述实验中V(CO2)(mL)与样品质量m(g)之间的关系式。
 和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
 不分解),产生
不分解),产生 (标准状况)和水0.45g,计算并确定该天然碱的化学式.
(标准状况)和水0.45g,计算并确定该天然碱的化学式.

 .
. 和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
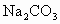 不分解),产生
不分解),产生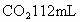 (标准状况)和水0.45g,计算并确定该天然碱的化学式.
(标准状况)和水0.45g,计算并确定该天然碱的化学式.

 .
.