题目内容
(10分)过量的铁溶于稀硫酸可得硫酸亚铁。等物质的量的硫酸亚铁与硫酸铵作用,能生成溶解度较小的硫酸亚铁铵晶体[![]() ,浅绿色晶体],该晶体的商品名称为摩尔盐。
,浅绿色晶体],该晶体的商品名称为摩尔盐。
(1)写出上述反应的化学方程式。
(2)若用![]()
![]() 硫酸来制备摩尔盐,计算生成摩尔盐的质量。
硫酸来制备摩尔盐,计算生成摩尔盐的质量。
(3)为了测定某批次莫尔盐的纯度,取该产品![]() 配成
配成![]() 溶液,取出
溶液,取出![]() 用
用![]()
![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() 。
。
①配平下列反应式:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
②试求产品中莫尔盐的质量分数 。
(1)![]() (2分)
(2分)
![]() (2分)
(2分)
(2)解:设生成![]() 的物质的量为
的物质的量为![]() 。由上述方程式知:
。由上述方程式知:
![]()
![]()
![]()
![]()
![]()
![]()
生成![]() 的质量为:
的质量为:![]() (2分)
(2分)
(3)①5、1、8、1、5、4![]() (2分) ②83.33% (2分)
(2分) ②83.33% (2分)

练习册系列答案
相关题目

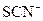 被过量的氯水氧化
被过量的氯水氧化 __________________________________________________
__________________________________________________ ______________________。
______________________。 1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______ __,据此可测得FeSO4溶液的物质的量浓度为______ __mol·L-1。
1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______ __,据此可测得FeSO4溶液的物质的量浓度为______ __mol·L-1。