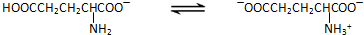题目内容
(8分)已知![]() 在水溶液中存在以上电离:
在水溶液中存在以上电离:
一级电离:![]() 二级电离:
二级电离:![]()
请回答一下问题:
(1)将0.1 mol?L-1的NaOH溶液与0.05 mol?L-1的![]() 溶液等体积混合,冷却至室温测得溶液的pH (填“等于7”、“大于7”或“小于7”)
溶液等体积混合,冷却至室温测得溶液的pH (填“等于7”、“大于7”或“小于7”)
(2)![]() 溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
。
(3)某温度下,在0.1 mol?L-1的![]() 溶液中,以下关系一定不正确的是( )
溶液中,以下关系一定不正确的是( )
A ![]()
B Ph>1
C ![]()
(1)大于7(2分)
(2)无法确定,(1分)![]() 溶液中同时存在
溶液中同时存在![]()
![]() 因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
(3)C、D(2分)

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目