题目内容
将6.4g铜和足量浓硝酸反应,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
(1)有多少摩尔硝酸被还原?
(2)产生的二氧化氮在标准状况下的体积是多少升?
(1)有多少摩尔硝酸被还原?
(2)产生的二氧化氮在标准状况下的体积是多少升?
0.2mol 4.48L
(1)6.4g铜全部被氧化,提供0.2mol电子.而1mol硝酸中+5价的N被还原成二氧化氮中+4价的N,需要得到1mol电子,所以只能还原0.2mol硝酸.
(2)由关系式Cu~2NO2,可知0.1mol的Cu与HNO3反应可得0.2mol的NO2,标况下体积应为:
0.2mol×22.4L/mol=4.48L.
(2)由关系式Cu~2NO2,可知0.1mol的Cu与HNO3反应可得0.2mol的NO2,标况下体积应为:
0.2mol×22.4L/mol=4.48L.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
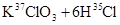

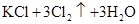 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )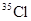
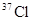
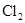 的相对分子质量大于71
的相对分子质量大于71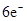
 单线桥”表示电子转移的方向和数目)
单线桥”表示电子转移的方向和数目)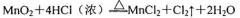
 Al2O3+2Fe
Al2O3+2Fe