题目内容
(08山东省威海市模拟)下列判断正确的是( )
A.加入铝粉后产生氢气的溶液中可能大量共存NH4+、Na+、NO3-、S2-
B.25℃时,将氨水逐滴加入到稀H2SO4中至溶液pH=7:c(NH4+)=c(SO42-)
C.0.1mol/LK2CO3溶液中,加入一定量的水可使c(CO32-)更接近0.1mol/L
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑

(08山东省淄博模拟)(18分)在用FeSO4溶液与NaOH溶液反应制备白色的Fe(OH)2时,出现了“白色沉淀迅速转变为灰绿色,最后逐渐变成红褐色”的实验现象,如何解释出现灰绿色的现象,探究小组的同学产生了不同的观点:
①灰绿色物质就是红褐色的氢氧化铁跟白色的氢氧化亚铁的简单混合物;
②灰绿色物质是铁的一种新的氢氧化物,但其中不含Fe3+离子。
(1)验证观点①不正确的实验操作是: ,
验证观点②所需的试剂有: 。
(2)某同学查阅资料后,得到Fe(OH)2如下信息:

阅读该资料后,你对上述实验中出现灰绿色的现象的解释是:__________。
探究小组的同学在研究由Fe2+制备Fe(OH)2的过程中,甲、乙、丙、丁四位同学分别设计了如下4个实验方案:
甲方案:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
乙方案:应用钢铁吸氧腐蚀的原理,设计电池制备Fe(OH)2。
|
丙方案:按图实验,制备Fe(OH)2。 丁方案:按图实验,制备Fe(OH)2。(苯的作用是使电解质溶液隔绝空气)
回答下列问题:
①在甲方案中,所用FeSO4样品通常部分被氧化,写出在配制FeSO4溶液时,其操作过程及反应的离子方程式: 。
②在乙方案中,正极的电极反应式是: 。你认为该方案是否可行? ,若不可行请说明理由(若可行,则该空不需回答): 。
③在丙方案中,当容器B、A中均加入试剂并塞好橡皮塞后,还需要进行的操作是 。
④在丁方案中,在两电极之间的溶液中首先观察到白色沉淀。请写出b电极的电极反应式: 。则其电解质溶液可以是下列三项的 。
A.蒸馏水 B.NaC1溶液 C.NaOH溶液
(08山东省威海市质检)(8分)I.(1)已知298K时2C(s)+O2(g)=2CO(g) △H1=-221.01kJ?mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ?mol-1 则298K时CO(g)在O2(g)燃烧生成CO2(g) 的热化学反应方程式为:________。
(2)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。
该电池工作时的负极反应式为: ;
熔融盐中CO32-的物质的量在工作时 (填“增大”、“减少”、“不变”)。
|
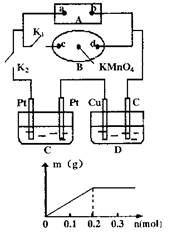
II.如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D
为电解槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为 极,通电一段时间后,观察到滤纸d端出现的现象是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示。则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置Cu极的电极反应式为 。