题目内容
50g物质的量浓度为C1的浓H2SO4,质量分数为W1,与体积为V的水混合后得到物质的量浓度为C2的稀H2SO4,质量分数为W2(以下填“>”“<”或“=”)(1)若W1=2W2,则C1______2C2,V______50mL.
(2)若C1=2C2,则W1______2W2,V______50mL.
【答案】分析:(1)浓硫酸的密度大于水,溶液的浓度越大,密度越大,利用c=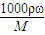 进行计算物质的量浓度,结合溶液密度判断物质的量浓度.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=
进行计算物质的量浓度,结合溶液密度判断物质的量浓度.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=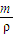 计算判断水的体积.
计算判断水的体积.
(2)浓硫酸的密度大于水,溶液的浓度越大,密度越大,利用c=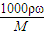 进行计算质量分数,结合溶液密度判断质量分数.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=
进行计算质量分数,结合溶液密度判断质量分数.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=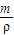 计算判断水的体积.
计算判断水的体积.
解答:解:(1)设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
c1=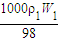 ,c2=
,c2=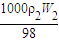
所以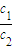 =
=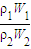 ,由于W1=2W2,所以
,由于W1=2W2,所以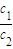 =
=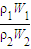 =
=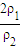 ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
设物质的量是浓度为c2mol?L-1硫酸溶液的质量为m,则
50g×W1=m×W2,所以稀释后硫酸溶液的质量m=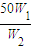 g,所以加入水的质量为
g,所以加入水的质量为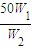 g-50g,由于W1=2W2,所以加入水的质量为
g-50g,由于W1=2W2,所以加入水的质量为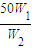 g-50g=50g,所以水的体积V=
g-50g=50g,所以水的体积V=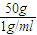 =50ml.
=50ml.
故答案为:>;=.
(2)设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
由c=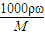 可知,W1=
可知,W1= ,W2=
,W2=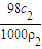
所以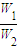 =
=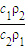 ,由于C1=2C2,所以
,由于C1=2C2,所以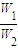 =
=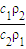 =
=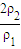 ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
设物质的量是浓度为c2mol?L-1硫酸溶液的质量为n,则
50g×W1=n×W2,所以稀释后硫酸溶液的质量n=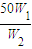 g,所以加入水的质量为
g,所以加入水的质量为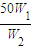 g-50g,由于W1<2W2,所以加入水的质量为
g-50g,由于W1<2W2,所以加入水的质量为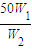 g-50g<50g,所以水的体积V<
g-50g<50g,所以水的体积V<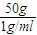 =50ml.
=50ml.
故答案为:<;<.
点评:考查物质的量浓度、质量分数的有关计算比较,难度较大,注意浓硫酸的密度大于水,溶液的浓度越大,密度越大.
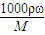 进行计算物质的量浓度,结合溶液密度判断物质的量浓度.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=
进行计算物质的量浓度,结合溶液密度判断物质的量浓度.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=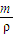 计算判断水的体积.
计算判断水的体积.(2)浓硫酸的密度大于水,溶液的浓度越大,密度越大,利用c=
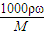 进行计算质量分数,结合溶液密度判断质量分数.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=
进行计算质量分数,结合溶液密度判断质量分数.根据溶质质量不变,计算稀释后溶液的质量,求出所加水的质量根据,V=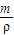 计算判断水的体积.
计算判断水的体积.解答:解:(1)设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
c1=
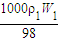 ,c2=
,c2=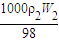
所以
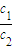 =
=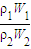 ,由于W1=2W2,所以
,由于W1=2W2,所以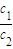 =
=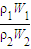 =
=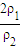 ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;设物质的量是浓度为c2mol?L-1硫酸溶液的质量为m,则
50g×W1=m×W2,所以稀释后硫酸溶液的质量m=
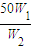 g,所以加入水的质量为
g,所以加入水的质量为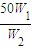 g-50g,由于W1=2W2,所以加入水的质量为
g-50g,由于W1=2W2,所以加入水的质量为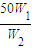 g-50g=50g,所以水的体积V=
g-50g=50g,所以水的体积V=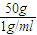 =50ml.
=50ml.故答案为:>;=.
(2)设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
由c=
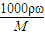 可知,W1=
可知,W1= ,W2=
,W2=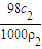
所以
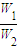 =
=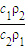 ,由于C1=2C2,所以
,由于C1=2C2,所以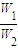 =
=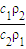 =
=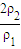 ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;设物质的量是浓度为c2mol?L-1硫酸溶液的质量为n,则
50g×W1=n×W2,所以稀释后硫酸溶液的质量n=
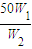 g,所以加入水的质量为
g,所以加入水的质量为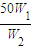 g-50g,由于W1<2W2,所以加入水的质量为
g-50g,由于W1<2W2,所以加入水的质量为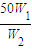 g-50g<50g,所以水的体积V<
g-50g<50g,所以水的体积V<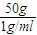 =50ml.
=50ml.故答案为:<;<.
点评:考查物质的量浓度、质量分数的有关计算比较,难度较大,注意浓硫酸的密度大于水,溶液的浓度越大,密度越大.

练习册系列答案
相关题目