题目内容
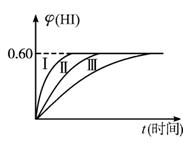
将1 mol I2(g)和2 mol H2(g)置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g);ΔH<0,并达到平衡。HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示:
2HI(g);ΔH<0,并达到平衡。HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示:

(1)达平衡时,I2(g)的物质的量浓度为_______ mol·L -1。
(2)若改变反应条件,在某条件下φ(HI)的变化如曲线(Ⅰ)所示,则该条件可能是______(填下列条件的序号)。?
①恒容条件下,升高温度?
②恒容条件下,降低温度?
③恒温条件下,缩小反应容器体积?
④恒温条件下,扩大反应容器体积?
⑤恒温、恒容条件下,加入适当催化剂?
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为_______(用一个含a、b、c的代数式表示)。
(1)0.05 (2)③⑤ (3)2b-4a=c??
解析:I2(g)+H2(g)![]() 2HI(g),是等体积反应,且正方向为吸热反应。?
2HI(g),是等体积反应,且正方向为吸热反应。?
(1)利用三段法求解:?
I2(g) + H2(g) ![]() 2HI(g)?
2HI(g)?
起始:1 mol 2mol 0?
变化:0.6 mol 1.2mol 0.6 mol?
平衡:0.4mol 0.8 mol 0.6 mol?
则c(I2)=0.4 mol/2 L=0.2 mol·L -1??
(2)图象知,改变条件,只是缩短了达平衡的时间,即提高了反应速率,可加催化剂或加压。
(3)由题意知建立了等效平衡。?
H2(g)+ I2(g) ![]() 2HI(g)?
2HI(g)?
起始1:1 mol 2 mol 0?
起始2:a mol b mol? c mol?
则只要符合初始比即可:
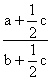 =
=![]() ,即2b-4a=c
,即2b-4a=c

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示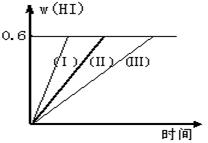
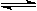 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: