题目内容
(12分)控制变量法是研究化学变化规侓的重要思想方法。请仔细观察下表中50 mL稀盐酸和1g碳酸钙反应的实验数据:
分析并回答下列问题:
(1)本反应属于________反应(填“吸热”或“放热”),反应的离子方程式为 。
(2)实验6和7表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其它因素还有__________,能表明这一规律的实验序号是1、2与_______。
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol·L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
(1)本反应属于________反应(填“吸热”或“放热”),反应的离子方程式为 。
(2)实验6和7表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其它因素还有__________,能表明这一规律的实验序号是1、2与_______。
(共12分)
(1)放热(1分);CaCO3+2H+=Ca2++CO2↑+H2O(2分)。
(2)温度(1分);温度越高(1分);8和9(2分)。
(3)反应物浓度越大,反应速率越快。(2分)
(4)接触面积(1分); 4和5(2分)。
(1)放热(1分);CaCO3+2H+=Ca2++CO2↑+H2O(2分)。
(2)温度(1分);温度越高(1分);8和9(2分)。
(3)反应物浓度越大,反应速率越快。(2分)
(4)接触面积(1分); 4和5(2分)。
试题分析:对比反映前后可以看到反应放热反应反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O。
(2)实验6和7表明,温度对反应速率有影响温度越高,反应速率越快,能表明同一规律的实验还有8和9。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是反应物浓度越大,反应速率越快。
(4)本实验中影响反应速率的其它因素还有接触面积,能表明这一规律的实验序号是1、2与4和5。
点评:通过控制变量法,研究化学反应速率的影响因素,抓住变量,也就是说只看变化的量。

练习册系列答案
相关题目
 4NO2(g)+ O2(g)。
4NO2(g)+ O2(g)。 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( ) 2C(g),下列各数据表示不同条件下的反应速率,
2C(g),下列各数据表示不同条件下的反应速率, 2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是 后测得密闭容器内的压强是起始时的0.9倍,在此时间内
后测得密闭容器内的压强是起始时的0.9倍,在此时间内 是
是
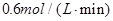


 2SO3(g)在10L的密闭容器中进行,测得4min内,SO2的物质的量由20mol减小到4mol。若其它条件不变,SO2的浓度变为0.8mol/L,需要时间为( )
2SO3(g)在10L的密闭容器中进行,测得4min内,SO2的物质的量由20mol减小到4mol。若其它条件不变,SO2的浓度变为0.8mol/L,需要时间为( ) 的容器中进行,8分钟消耗反应物
的容器中进行,8分钟消耗反应物 。在另一条件下,该气体在
。在另一条件下,该气体在 容器中发生分解,10分钟内消耗反应物10g。在这两种情况下,平均反应速率之比为 。
容器中发生分解,10分钟内消耗反应物10g。在这两种情况下,平均反应速率之比为 。