题目内容
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
(1)1:2 (2分)
(2)78%(2分)
(3)0.856(2分)
(4)①50∶1
②1.25 mol/L
③ (m+5.624)×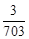 g)
g)
(2)78%(2分)
(3)0.856(2分)
(4)①50∶1
②1.25 mol/L
③ (m+5.624)×
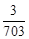 g)
g)试题分析:
(1)解:设Mg和Al的物质的量为x和y
Mg+H2SO4 ="Mg" SO4+ H2↑ 2 Al+3H2SO4 = Al2 (SO4)3+ 3H2↑
x x 2 3
y 3/2 y
x+ 3/2 y =0.2 24 x+ 27*y=3.90 x=0.05 y=0.1
答:镁铝合金中物质的量n(Mg): n(Al)= 0.05: 0.1=1:2
(2)解:设FeS2的质量为x
4FeS2 +11O2=2Fe2O3 +8SO2 ⊿m
4*120 (4*120-2*160)
x (10-7.4)
x=7.8
答:硫铁矿中FeS2的质量分数为7.8*100%/10=78%
(3)设HN O3的物质的量浓度为x;Al的物质的量为y;Fe的物质的量为z
OC段:HN O3——--NaOH EF段:Al-----Al(OH)3——----- NaOH——------Na AlO2
100x 4*3 y 4*(18.5-16.5)/1000
x=0.12 y=0.008
CD段: Al——3 OH———Al(OH)3 Fe—— 3 OH———Fe(OH)3
3 1 3 1
0.024 0.008 4*(15-3)/1000-0.024 0.008
A点沉淀是氢氧化铁,质量为: 107*0.008=0.856(g)
(4)①nCO2= 0.224/22.4=0.01(mol)
C—— CO2
0.01 0.01 nFe=(28.12-0.01*12)/56=0.5(mol)
此钢样粉末中铁和碳的物质的量之比为 nFe:nC=0.5: 0.01=50∶1
②由表可知:Ⅲ钢样过量,由氢气量可求硫酸的量,n H2=2.8/22.4=0.125(mol)
H2SO4------ H2
0.05
该硫酸溶液的物质的量浓度为C=n/V=0.125/0.1=1.25( mol/L)
③(设恰好溶解时钢样的质量为x,对于实验I和III,
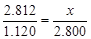 x=7.030g
x=7.030g此时加入的钢样的质量为m=7.030-5.624=1.406g
①当钢样粉末中的铁未全部溶解时,即m>1.406g
反应结束后剩余固体的质量为m+5.624-0.125×56=(m-1.376)g
②当钢样粉末中的铁全部溶解时,即m≤1.406g
反应结束后剩余固体的质量为 (m+5.624)×
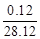 g 或 (m+5.624)×
g 或 (m+5.624)×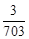 g)
g)
练习册系列答案
相关题目
