题目内容
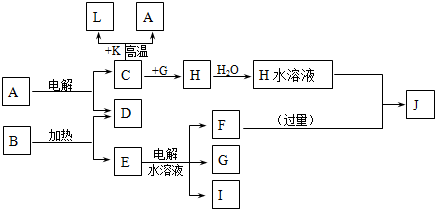
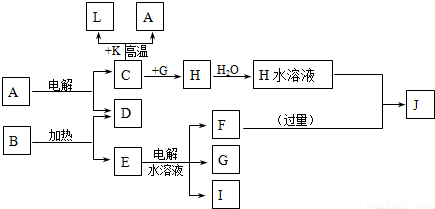
A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图.
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属.请回答下列问题:
(1)若K为红棕色粉末,则引发C与K反应的操作为______
(2)写出电解E水溶液的化学方程式______.
(3)J与H反应的离子方程式为______.若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为______.
解:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;L是目前应用最广泛的金属,结合转化关系中C+K=A+L,和(1)中K为红棕色粉末,推断L为Fe,C为Al,K为Fe2O3;已知A在工业上常用作耐火材料,A为Al2O3,形成D的元素的原子最外层电子数是次外层的3倍,结合转化关系中A电解得到D为O2,B在焰色反应中呈紫色(透过蓝色钴玻璃),判断含有钾元素,B加热分解得到氧气和E,证明B为KClO3,推断E为KCl,电解水溶液得到F为KOH,G,I为氢气和氯气;结合转化关系中C+G=H可知,G为Cl2,I为H2,H为AlCl3,J为KAlO2,
(1)若K为红棕色粉末,则引发C与K反应的操作为铝热剂反应的引发条件为:铝热剂表面铺一层氯酸钾,将镁条点燃到插入固体混合物,
故答案为:铝热剂表面铺一层氯酸钾,将镁条点燃到插入固体混合物;
(2)电解E为KCl水溶液,反应的化学方程式为:2KCl+2H2O 2KOH+Cl2↑+H2↑,故答案为:2KCl+2H2O
2KOH+Cl2↑+H2↑,故答案为:2KCl+2H2O 2KOH+Cl2↑+H2↑;
2KOH+Cl2↑+H2↑;
(3)J为KAlO2与H为AlCl3在水溶液中发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓; 若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J(KAlO2),依据反应的定量关系,Al2O3~2Al~2AlCl3;2KClO3 2KCl+3O2↑,2KCl+2H2O
2KCl+3O2↑,2KCl+2H2O 2KOH+Cl2↑+H2↑;
2KOH+Cl2↑+H2↑;
AlCl3+4KOH=KAlO2+3KCl+2H2O;则AB在反应过程中的定量关系为:Al2O3~2Al~2AlCl3~8KOH~8KCl~8KClO3;则A、B的物质的量之比为 1:8;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;1:8.
分析:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;L是目前应用最广泛的金属,结合转化关系中C+K=A+L,和(1)中K为红棕色粉末,推断L为Fe,C为Al,K为Fe2O3;已知A在工业上常用作耐火材料,A为Al2O3,形成D的元素的原子最外层电子数是次外层的3倍,结合转化关系中A电解得到D为O2,B在焰色反应中呈紫色(透过蓝色钴玻璃),判断含有钾元素,B加热分解得到氧气和E,证明B为KClO3,推断E为KCl,电解水溶液得到F为KOH,G,I为氢气和氯气;结合转化关系中C+G=H可知,G为Cl2,I为H2,H为AlCl3,J为KAlO2,依据判断物质回答问题;
点评:本题考查了物质转化关系的分析判断,物质性质的应用,主要是铝热反应的应用,电解氯化钾溶液错误的判断,铝及其化合物的反应特征应用,题目难度中等.
(1)若K为红棕色粉末,则引发C与K反应的操作为铝热剂反应的引发条件为:铝热剂表面铺一层氯酸钾,将镁条点燃到插入固体混合物,
故答案为:铝热剂表面铺一层氯酸钾,将镁条点燃到插入固体混合物;
(2)电解E为KCl水溶液,反应的化学方程式为:2KCl+2H2O
 2KOH+Cl2↑+H2↑,故答案为:2KCl+2H2O
2KOH+Cl2↑+H2↑,故答案为:2KCl+2H2O 2KOH+Cl2↑+H2↑;
2KOH+Cl2↑+H2↑;(3)J为KAlO2与H为AlCl3在水溶液中发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓; 若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J(KAlO2),依据反应的定量关系,Al2O3~2Al~2AlCl3;2KClO3
 2KCl+3O2↑,2KCl+2H2O
2KCl+3O2↑,2KCl+2H2O 2KOH+Cl2↑+H2↑;
2KOH+Cl2↑+H2↑;AlCl3+4KOH=KAlO2+3KCl+2H2O;则AB在反应过程中的定量关系为:Al2O3~2Al~2AlCl3~8KOH~8KCl~8KClO3;则A、B的物质的量之比为 1:8;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;1:8.
分析:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;L是目前应用最广泛的金属,结合转化关系中C+K=A+L,和(1)中K为红棕色粉末,推断L为Fe,C为Al,K为Fe2O3;已知A在工业上常用作耐火材料,A为Al2O3,形成D的元素的原子最外层电子数是次外层的3倍,结合转化关系中A电解得到D为O2,B在焰色反应中呈紫色(透过蓝色钴玻璃),判断含有钾元素,B加热分解得到氧气和E,证明B为KClO3,推断E为KCl,电解水溶液得到F为KOH,G,I为氢气和氯气;结合转化关系中C+G=H可知,G为Cl2,I为H2,H为AlCl3,J为KAlO2,依据判断物质回答问题;
点评:本题考查了物质转化关系的分析判断,物质性质的应用,主要是铝热反应的应用,电解氯化钾溶液错误的判断,铝及其化合物的反应特征应用,题目难度中等.

练习册系列答案
相关题目