题目内容
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①写出B分子的结构式 ,B分子中各原子最外层是否都满足8电子结构? (填“是”或“否”)。
②向50mL4mol/L的NaOH溶液中通入1.12L气体B(标准状况),反应后溶液中溶质的物质的量之比为 (填化学式及其物质的量之比)。
③4gA完全燃烧放出131.2kJ的热量,写出表示A的燃烧热的热化学方程式 。
(2)若A为第三周期某元素的氯化物,0.1mol/LE的水溶液pH=13,且其焰色反应颜色呈黄色。
①E的化学式 ,E中含有的化学键类型为 。
②写出图中A的溶液→B的溶液的离子方程式 。
(1)①O=C=O 是 ②n(Na2CO3):n(NaOH)=1:2 ③C(s)+ O2(g)=CO2(g) △H= ![]() 393.6kJ/mol
393.6kJ/mol
(2)①NaOH 离子键、共价键 ②Al3++4OH-=AlO2-+2H2O
解析:(1)①组成A单质的元素是自然界中形成化合物种类最多的元素,所以A是C元素,E则为氧气,少量生成CO,过量生成CO2,B的结构式就是O=C=O,根据其电子式可以判断都满足8电子稳定结构;② NaOH的物质的量是0.2 mol,CO2是0.05 mol,即CO2的量不足,按NaOH计算;③根据热化学方程式的写法,就是C(s)+ O2(g)=CO2(g) △H=  393.6kJ/mol;(2)①E是NaOH,则A就是氢氧化铝,B是偏铝酸钠,D是氢氧化铝。
393.6kJ/mol;(2)①E是NaOH,则A就是氢氧化铝,B是偏铝酸钠,D是氢氧化铝。

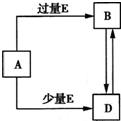 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( ) 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).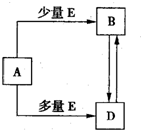 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).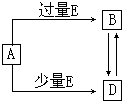 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).