题目内容
(5分)
(1)硫和氧都是 族的元素,乙醇可以看成是水分子中的一个H原子被乙基替代的衍生物,因此硫化氢分子中的一个H原子也可以被乙基替代,得到乙硫醇,其结构简式为 。
(2)根据上述规律,异丙硫醇、苯硫酚的分子式分别是C3H8S和 。
(3)苯硫酚具有比苯酚还强的酸性,则苯硫酚与氢氧化钾反应的化学方程式为: 。
(4)硫醇也具有一定的酸性,可以与碱反应,则1mol化合物HSCH2CH(NH2)COOH最多能与 mol NaOH反应。
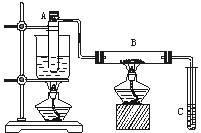
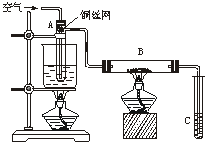
(8分)如图学习小组甲、乙所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是蒸馏水。请回答下列问题:
![]()
![]()
![]()
![]() 甲 乙
甲 乙
⑴甲中B内放置的是 ; 乙中B内放置的是 。乙向试管A中鼓入空气的目的是_______ 。
⑵ 甲乙装置中A试管为什么都要用水浴加热: 。
⑶甲中玻璃管中可观察到的现象是__________ ;
甲和乙中反应的化学方程式分别是________ ;
。
⑷ 在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是______________。

 天天练口算系列答案
天天练口算系列答案(14分) 某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应的焓变(△H)情况如下表所示。
| 物质 | O2 | S | Se | Te |
| ΔH(kJ·mol-1) | -242 | -20 | 81 |
|
请回答下列问题:
(1)写出氧族元素中含有18个电子的两种氢化物的化学式 、 。
(2)写出硒化氢发生分解反应的热化学方程式: 。
(3)已知H2Te分解反应的ΔS>0,ΔH=-154kJ·mol-1,请解释Te和H2不能直接化合的原因
。
(4)H2S的水溶液显弱酸性,写出其电离方程式 ;它的第一级电离常数可用Ka1来表示,当温度升高时,Ka1的值 (填“一定增大”、“一定减小”或“不能确定”)。
(5)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 molO2 和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和α(乙),则反应的平衡常数Kc= L·mol-1(填写具体数据),此时α(乙) 50%(填“大于”、“小于”或“等于”)。
 (填“一定增大”、“一定减小”或“不能确定”)。
(填“一定增大”、“一定减小”或“不能确定”)。