题目内容
 根据所学化学反应原理,解决以下问题:
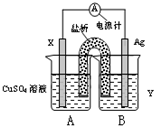
根据所学化学反应原理,解决以下问题:(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.回答下列问题:
①电极X的材料和电解质溶液Y分别为
Cu
Cu
、AgNO3溶液
AgNO3溶液
;②盐桥中K+移向
B
B
(填“A”或“B”);③银电极发生的电极反应为
Ag++e-=Ag
Ag++e-=Ag
.(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
根据盖斯定律写出单质碳和水蒸气反应生成水煤气的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
.分析:(1)①在原电池中,根据2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)知,铜作负极,银作正极,A池中的电解质溶液为硫酸铜,B池中的电解质溶液为可溶性的银盐;
②原电池放电时,盐桥中的阳离子向正极方向移动;
③银极上银离子得电子发生还原反应;
(2)依据盖斯定律计算得到热化学方程式.
②原电池放电时,盐桥中的阳离子向正极方向移动;
③银极上银离子得电子发生还原反应;
(2)依据盖斯定律计算得到热化学方程式.
解答:解:(1)①根据2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)知,失电子的金属Cu为负极,得电子的阳离子Ag+是B池中电解质中的阳离子,该电解质溶液可以选取AgNO3溶液,
故答案为:Cu;AgNO3溶液;
②原电池放电时,盐桥中的钾离子移向正极B池,故答案为:B;
③银电极上,溶液中的银离子得电子发生还原反应,从而析出银单质,电极反应为:Ag++e-=Ag,故答案为:Ag++e-=Ag;
(2)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1.
故答案为:Cu;AgNO3溶液;
②原电池放电时,盐桥中的钾离子移向正极B池,故答案为:B;
③银电极上,溶液中的银离子得电子发生还原反应,从而析出银单质,电极反应为:Ag++e-=Ag,故答案为:Ag++e-=Ag;
(2)①C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
②H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
③CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律,①-②-③得到:单质碳和水蒸气生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1.
点评:本题考查原电池原理和盖斯定律,明确原电池放电时,盐桥中阴阳离子的移动方向,为易错点.

练习册系列答案
相关题目
 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题. ”)
”) 和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1 V2(填“<”、“>”或“=”)
和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1 V2(填“<”、“>”或“=”) 6 kJ。该反应的热化学方程式______________________________________。
6 kJ。该反应的热化学方程式______________________________________。