题目内容
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
22.02 |
20.00 |
|
2 |
0.10 |
22.00 |
20.00 |
|
3 |
0.10 |
21.98 |
20.00 |
(1)滴定达到终点的现象是 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用右图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成
测定结果(待测液浓度值)偏高的有 (漏选得1分,错选、多选得0分):
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
(1)最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色
8.2—10 (2)0.11mol/L (3)丙 (4)ADE
【解析】
试题分析:(1)滴定终点的现象为“溶液恰好由无色变为浅红色”,即可判断达到滴定终点;此时溶液为碱性,因此其pH为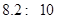 。
。
(2)消耗NaOH溶液的体积为: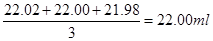 。所测稀盐酸的浓度为:
。所测稀盐酸的浓度为: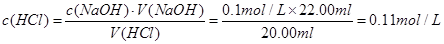 。
。
(3)属于基本操作,考生只要识记即可。
(4)A、定容时,加水超过刻度线,导致标准液浓度偏小,滴定时所需体积变大,因此最终待测液的浓度偏高。
B、锥形瓶水洗后直接装待测液对滴定结果无影响。
C、酸式滴定管水洗后未用待测稀盐酸溶液润洗,使得酸式滴定管中残留有水分,使得稀盐酸稀释,导致最终结果偏低。
D、滴定到达终点时,仰视读出滴定管读数,会使得消耗NaOH体积增大,从而导致最终结果偏高。
E、碱式滴定管尖嘴部分有气泡,滴定后消失,使得消耗NaOH体积增大,从而导致最终结果偏高。
考点:酸碱中和滴定
点评:本题考查酸碱中和滴定,属于课本的重要实验之一,也是高考的常见考点。此题的难点在于误差的分析,对于任何题目,涉及到误差分析时,应结合计算公式进行分析,考虑错误操作对公式中的量的大小的影响。

(13分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
|
1 |
0.10 |
20.02 |
20.00 |
|
2 |
0.10 |
20.00 |
20.00 |
|
3 |
0.10 |
19.00 |
20.00 |
|
4 |
0.10 |
19.98 |
20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有_________________________________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是________________。滴定达到终点的现象是_______________________________________。
(3)根据上述数据,可计算出该盐酸的浓度为 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空: 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空: 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验: