题目内容
(8分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)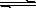 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
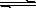 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
(1)5 (2)6
考查溶度积常数和pH的有关计算。
(1)根据氢氧化铜的溶度积常数表达式可知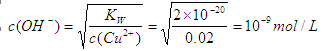 ,所以氢离子浓度为10-5mol/L,因此pH等于5。
,所以氢离子浓度为10-5mol/L,因此pH等于5。
(2)Cu2+浓度降至原来的千分之一后,铜离子的浓度变为2×10-4mol/L,所以根据氢氧化铜的溶
度积常数表达式可知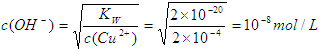
所以氢离子浓度为10-6mol/L,因此pH等于6。
(1)根据氢氧化铜的溶度积常数表达式可知
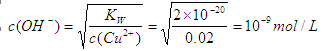 ,所以氢离子浓度为10-5mol/L,因此pH等于5。
,所以氢离子浓度为10-5mol/L,因此pH等于5。(2)Cu2+浓度降至原来的千分之一后,铜离子的浓度变为2×10-4mol/L,所以根据氢氧化铜的溶
度积常数表达式可知
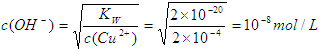
所以氢离子浓度为10-6mol/L,因此pH等于6。

练习册系列答案
相关题目
 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是 Ca(OH)2(aq),
Ca(OH)2(aq),
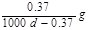
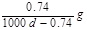
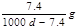
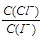 约为1.02×10-3
约为1.02×10-3 Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是 ,沉淀的速率和溶解的速率相等
,沉淀的速率和溶解的速率相等