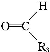
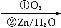题目内容
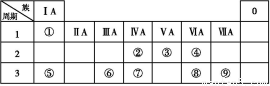
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。A原子L层的成对电子数和未成对电子数相等,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是 (用对应的元素符号表示);基态D原子的电子排布式为 。
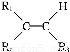
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取 杂化;B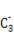 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。
(3)1 mol AB-中含有的π键个数为 。
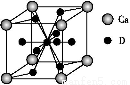
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
(1)C<O<N 1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)sp2 平面三角形
(3)2NA或2×6.02×1023
(4)1∶5
(5)5 0.083 g·cm-3
【解析】A原子L层的电子排布图为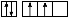 ,故A为C元素;地壳中含量最多的元素是O元素,故C为O元素;最外层p轨道的电子为半充满结构的元素是ⅤA族元素,结合A和C的核电荷数可知B为N元素;据D的描述可知,其四个电子层的电子数分别为2、8、18、1,故为Cu元素。(1)由于N元素p轨道处于半充满状态,故第一电离能最大,则有C<O<N,基态Cu原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。(2)根据价层电子对互斥理论可知在H2CO3分子中的C原子以及N
,故A为C元素;地壳中含量最多的元素是O元素,故C为O元素;最外层p轨道的电子为半充满结构的元素是ⅤA族元素,结合A和C的核电荷数可知B为N元素;据D的描述可知,其四个电子层的电子数分别为2、8、18、1,故为Cu元素。(1)由于N元素p轨道处于半充满状态,故第一电离能最大,则有C<O<N,基态Cu原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。(2)根据价层电子对互斥理论可知在H2CO3分子中的C原子以及N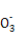 中的N原子上都没有孤电子对,故C原子采用sp2杂化方式,N
中的N原子上都没有孤电子对,故C原子采用sp2杂化方式,N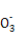 空间构型为平面三角形结构。(3)在CN-中,C原子与N原子之间是共价三键,故含有的π键个数为2NA。(4)如图,钙在立方体的顶点,故含有8×
空间构型为平面三角形结构。(3)在CN-中,C原子与N原子之间是共价三键,故含有的π键个数为2NA。(4)如图,钙在立方体的顶点,故含有8×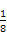 =1个,而Cu原子位于面上和体心中,故有8×
=1个,而Cu原子位于面上和体心中,故有8×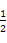 +1=5个。(5)结合(4)以及合金的化学式可知n=5,氢在合金中的密度=
+1=5个。(5)结合(4)以及合金的化学式可知n=5,氢在合金中的密度=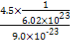 g·cm-3=0.083 g·cm-3。
g·cm-3=0.083 g·cm-3。

草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
实验步骤 | 现象与结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
步骤3:取步骤2得到的少量固体于试管中,滴加 |
|
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2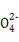 +3Mn
+3Mn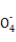 +24H+
+24H+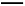 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2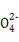 )= ;FeC2O4 的质量分数为 (精确到0.01%)。
)= ;FeC2O4 的质量分数为 (精确到0.01%)。
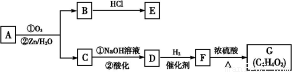
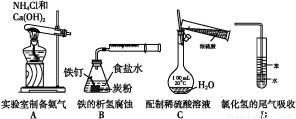
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
物质 | 类别 | 化学性 质预测 | 实验验证 | ||
实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O
|
与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
(2)该探究小组还根据SO2中S元素的化合价,预测并通过实验探究SO2的其他性质。探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等。探究过程的实验装置图如图所示,请回答下列问题。
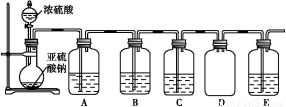
①请你完成下列表格。
装置 | 药品 | 作用 |
A |
| 验证二氧化硫的还原性 |
B |
|
|
C | 品红溶液 |
|
②A中发生反应的离子方程式为 。
③实验时C中的实验现象是 。
④D装置的作用是 。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明: 。