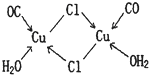
题目内容
在N2、CO、H2O、CCl4、CO2、P4(白磷)六种分子中:
(1)由非极性键构成的非极性分子有 ;
(2)由极性键构成的极性分子有 ;
(3)由极性键构成的非极性分子有 .
(1)由非极性键构成的非极性分子有
(2)由极性键构成的极性分子有
(3)由极性键构成的非极性分子有
分析:由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键.分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答:解:(1)N2中含有非极性键,是直线型,结构对称,分子中正负电荷重心重叠,为非极性分子;P4中含有非极性键,是正四面体型,结构对称,分子中正负电荷重心重叠,为非极性分子,故答案为:N2、P4;
(2)CO为直线型结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子;H2O为V形结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故答案为:CO、H2O;
(3)CCl4为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故答案为:CCl4、CO2.
(2)CO为直线型结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子;H2O为V形结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故答案为:CO、H2O;
(3)CCl4为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故答案为:CCl4、CO2.
点评:本题考查极性分子和非极性分子判断,题目难度不大,注意从分子结构是否对称判断分子的极性,对于ABn型分子,若中心原子A的最外层电子全部成键为非极性分子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式 (1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善.
(1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善. (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁