题目内容
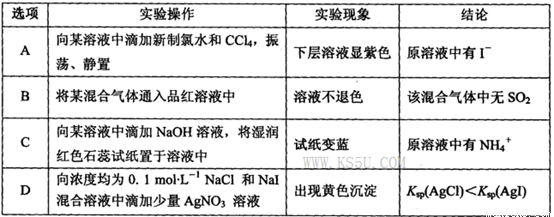
下列实验操作、现象和结论正确的是
【答案】
A
【解析】
试题分析:A.向某溶液中通入氯气后发生反应:Cl2+2I-=2Cl-+I2.由于I2的四氯化碳溶液呈紫色,I2在四氯化碳中的溶解度比在水中大,而四氯化碳与水互不相溶,四氯化碳的密度比水大。故再加入四氯化碳振荡静止后,分层,下层为紫色。正确。若某气体中同时含有SO2和Cl2等氧化性气体,则将混合气体通入到品红溶液时由于发生反应:SO2+Cl2+2H2O=2HCl+H2SO4,产物都没有漂白性。故不能确定混合气体中是否含有SO2气体。错误。C.由于加入的NaOH溶液,所以将湿润的红色石蕊试纸置于溶液中一定变为蓝色。若检验NH4+的存在,应该向溶液中加入NaOH溶液并加热,将湿润的红色石蕊试纸置于试管口,如果试纸变为蓝色,证明反应放出了NH3气,原溶液中含有NH4+. 错误。D.向浓度均为0.1mol/L的NaCl和NaI混合溶液中滴加AgNO3溶液时由于KSP(NaCl)>KSP(NaI),所以首先产生溶解度小的AgI黄色沉淀。错误。
考点:考查离子的检验和沉淀产生的先后顺序的知识。

练习册系列答案
相关题目