题目内容
(8分)(1)(3分)下列各组物质中: ③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;____ __; 互为同素异形体是:____ __;
互为同分异构体是:___ ___。
(2)(5分)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3+ H2SO4=== K2SO4+ Fe2(SO4)3+ NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有 g氧化剂参加反应
(1)②;①;⑤(各1分)
(2)6 FeSO4 + 2KNO3 + 4H2SO4 === 1K2SO4 + 3Fe2(SO4)3 + 2NO↑+ 4H2O(2分)
①Fe2(SO4)3 (1分) ②10.1(2分)
解析:(1)同位素的定义:质子数相同而中子数不同的同一元素的不同核素,即同位素的研究对象是原子;
同素异形体的定义:同种元素形成的性质不同的单质,即同素异形体的研究对象是单质;
同分异构体的定义:分子式相同而结构不同的化合物,即同分异构体的研究对象是化合物;
(2)利用化合价升降相等:Fe由+2价升高到+3价,N由+5价降低到+2价,
则(3-2)×6=(5-2)×2,即FeSO4系数为6,Fe2(SO4)3系数为3,KNO3、NO系数均为2;再利用K原子守恒,得K2SO4系数为1;再利用S原子守恒,得H2SO4系数为4;再利用H原子守恒,得H2O系数为4;最后,可利用O原子守恒检查配平是否正确;
①Fe元素由+2价升高到+3价,被氧化,得氧化产物Fe2(SO4)3;
②N元素由+5价降低到+2价,被还原,做KNO3氧化剂,在方程式中转移了6个电子,
即:2 KNO3 — 6e-
2 6
n(KNO3) 0.3mol,得:n(KNO3)=0.1mol,则m(KNO3)= 0.1 mol×101g.mol-1=10.1g

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案(9分)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。
(1)下列各组物质中有一种物质从化学性质角度看与其它物质不属于同一类,请将其挑出来(余下的必须属于同类),并说明理由。
| 物质组 | 不属于同类的物质 | 理由 |
| (1)MgO、CuO、CaO、Al2O3 |
|
|
| (2) CO、CO2、SO2、Mn2O7 |
|
|
| (3)HCl、H2SO4、HNO3、H3PO4 |
|
|
(2)请对以下过程形成的分散系进行分类
①花生油加入到水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中逐滴加入少量氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘水和酒精的混合物。
属于浊液的是:______(填序号,下同);属于溶液的是:________;属于胶体的是:_________。
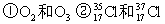 ③H2O和 D2O ④ CH3CH3和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
③H2O和 D2O ④ CH3CH3和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3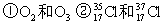 ③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3
⑤ CH3-CH2-OH和CH3-O-CH3
③H2O和 D2O ④ CH3CH3 和CH3CH2CH2CH3
⑤ CH3-CH2-OH和CH3-O-CH3