题目内容
高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
(1)该反应的平衡常数表达式为 。
(2)温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减小”或“不变”)。
(3)1 373 K时测得高炉中c(CO2)="0.025" mol/L,c(CO)="0.1" mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
 Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。(1)该反应的平衡常数表达式为 。
(2)温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减小”或“不变”)。
(3)1 373 K时测得高炉中c(CO2)="0.025" mol/L,c(CO)="0.1" mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
(1)K=c(CO2)/c(CO) (2)增大
(3)否 大于
因为Qc=c(CO2)/c(CO)="0.025" mol/L/0.1 mol/L=0.25<0.263,故平衡向右移动,v(正)>v(逆)
(3)否 大于
因为Qc=c(CO2)/c(CO)="0.025" mol/L/0.1 mol/L=0.25<0.263,故平衡向右移动,v(正)>v(逆)
(1)根据反应FeO(s)+CO(g) Fe(s)+CO2(g)可知,该反应的平衡常数表达式为K=c(CO2)/c(CO)。
Fe(s)+CO2(g)可知,该反应的平衡常数表达式为K=c(CO2)/c(CO)。
(2)因为正反应为吸热反应,升高温度,平衡常数增大。
(3)Qc=c(CO2)/c(CO)="0.025" mol/L/0.1 mol/L=0.25<0.263,所以反应没有达到平衡,反应向正反应方向移动,正反应速率大于逆反应速率。
 Fe(s)+CO2(g)可知,该反应的平衡常数表达式为K=c(CO2)/c(CO)。
Fe(s)+CO2(g)可知,该反应的平衡常数表达式为K=c(CO2)/c(CO)。(2)因为正反应为吸热反应,升高温度,平衡常数增大。
(3)Qc=c(CO2)/c(CO)="0.025" mol/L/0.1 mol/L=0.25<0.263,所以反应没有达到平衡,反应向正反应方向移动,正反应速率大于逆反应速率。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 CO(g)+H2(g)达到平衡的标志是( )
CO(g)+H2(g)达到平衡的标志是( )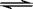 2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题:
2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题: 2Z(g),此反应达到平衡的标志是( )
2Z(g),此反应达到平衡的标志是( ) H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
 2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )
2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )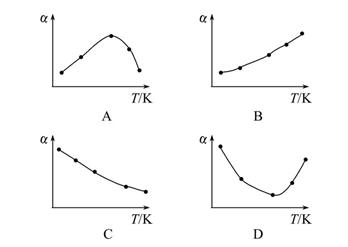
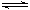 N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是( )
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是( )