题目内容
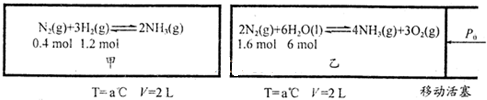
恒温、恒容的条件下对于N2(g)+3H2(g)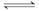 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的压强不变
D.N2、H2、NH3分子数之比为1:3 :2的状态
【答案】
C
【解析】
试题分析:可逆反应达到化学平衡状态的实质是正逆反应速率相等但不为0。会生成断开1个N≡N键的同时,必然会生成2分子氨气,即6个N—H键生成,A不正确。密度是气体的质量和容器体积的比值,反应前后气体质量和容器体积均不变,所以在任何时刻混合气体的密度不变,B不正确。物质的量之比等于压强之比,混合气体的压强不变,说明物质的量也不变化了,既说明达到化学平衡状态了,所以C可以说明。N2、H2、NH3分子数之比1∶3∶2的状态不一定满足正逆反应速率相等,D不正确。答案选C。
考点:化学平衡状态的标志。

练习册系列答案
相关题目
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池. (2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.