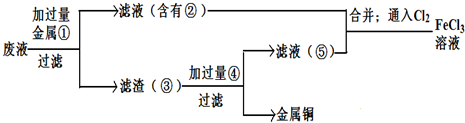
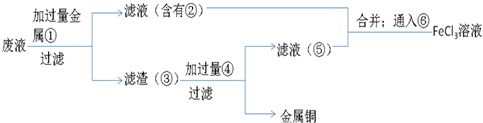
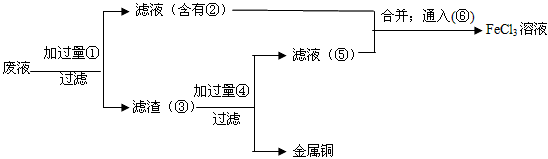
题目内容
下列实验中金属或氧化物可以完全溶解的是B.1 mol MnO2粉末与400 mL 10 mol·L-1的盐酸共热
C.常温下1 mol铝片投入到200 mL 18.4 mol·L-1硫酸中
D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中
D
解析:
B.1 mol MnO2粉末与400 mL 10 mol·L-1的盐酸反应时盐酸的浓度逐渐减小最后不再反应,MnO2粉末不能完全溶解。
C.常温下1 mol铝片投入到200 mL 18.4 mol·L-1硫酸时发生钝化不溶解。
D.含4 mol HNO3的浓硝酸能使HNO3完全作为氧化剂可氧化1 mol铜片。

练习册系列答案
相关题目