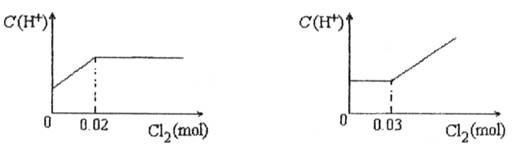
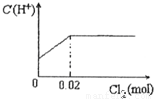
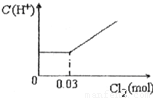
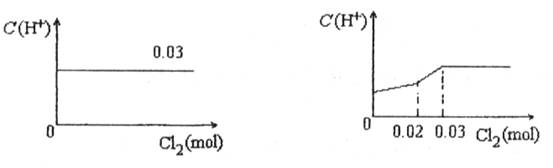题目内容
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中C(H+)与Cl2用量的关系是( )A.
B.
C.

D.
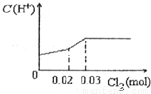
【答案】分析:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化.
解答:解:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl,
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3是中强酸,H2SO4为强酸,溶液中的C(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化
Br-:
Cl2 +2HBr=Br2 +2HCl,
0.01mol 0.02mol
HBr全部转变为HCl,C(H+)不变,故选:D.
点评:本题考查了氧化还原反应的计算,注意反应的先后顺序,难度不大.
解答:解:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl,
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3是中强酸,H2SO4为强酸,溶液中的C(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化
Br-:
Cl2 +2HBr=Br2 +2HCl,
0.01mol 0.02mol
HBr全部转变为HCl,C(H+)不变,故选:D.
点评:本题考查了氧化还原反应的计算,注意反应的先后顺序,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
|
阳离子 |
Na+、Al3+、Ba2+、H+、NH4+ |
|
阴离子 |
SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______ (填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______ (填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为____________________
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。