题目内容

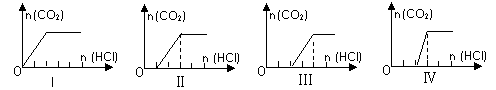
B、Ⅱ图表示开始加入1mol盐酸要和氢氧化钠发生中和反应,有1mol氢氧化钠剩余,一定不会存在碳酸氢钠;
C、Ⅲ图表示开始加入2mol盐酸要和氢氧化钠发生中和反应,有2mol氢氧化钠剩余,然后根据碳酸钠和盐酸的反应来确定碳酸钠的量;
D、Ⅳ图表示开始加入2mol盐酸要和氢氧化钠发生中和反应,有2mol氢氧化钠剩余,然后根据碳酸钠和盐酸的反应来确定碳酸钠的量.
B:滴入盐酸后两个单位才开始产生二氧化碳,说明氢氧化钠的量是两个单位,后来又反应了两个单位才使二氧化碳全反应出来,按照盐酸和碳酸钠2:1反应,存在氢氧化钠剩余,则一定不存在碳酸氢钠,故B错误;
C、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明溶液中还有氢氧化钠,盐酸和碳酸钠2:1反应,又消耗2mol盐酸所有的二氧化碳全放出,所以碳酸铵的物质的量是1mol,即c(NaOH)=2c(Na2CO3),故C错误;
D、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明溶液中还有氢氧化钠,再加1个单位盐酸放出全部二氧化碳,则含有氢氧化钠和碳酸钠的量之比是1:1,故D错误.
故选A.

向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | I | c(Na+) = c(HCO3-) |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-) < c(HCO3-) |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-) > c(CO32-) |
| D | Na2CO3 | Ⅳ | c(Na+) = c(CO32-) + c(HCO3-) + c(H |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
|
| 溶液组成主要成分 | 溶液中离子浓度关系 |
| A | NaHCO3、Na2CO3 | c(CO32-) < c(HCO3-) |
| B | NaOH 、 Na2CO3 | c(OH-)<c(CO32-) |
| C | Na2CO3 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3、NaOH | c(Na+) = c(HCO3-) |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
|
|
溶液组成主要成分 |
溶液中离子浓度关系 |
|
A |
NaHCO3、Na2CO3 |
c(CO32-) < c(HCO3-) |
|
B |
NaOH 、 Na2CO3 |
c(OH-)<c(CO32-) |
|
C |
Na2CO3 |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
|
D |
NaHCO3、NaOH |
c(Na+) = c(HCO3-) |
(09上海奉贤区4月模拟)向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
![]()
![]()
![]()
![]() 则下列分析都正确的组合是:
则下列分析都正确的组合是:
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 |
A | NaHCO3、Na2CO3 | Ⅱ | c(CO32-) < c(HCO3-) |
B | NaOH 、 Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
C | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
D | NaHCO3 | I | c(Na+) = c(HCO3-) |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
| 溶液组成主要成分 | 溶液中离子浓度关系 | |
| A | NaHCO3、Na2CO3 | c(CO32-) < c(HCO3-) |
| B | NaOH 、 Na2CO3 | c(OH-)<c(CO32-) |
| C | Na2CO3 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D | NaHCO3、NaOH | c(Na+) = c(HCO3-) |