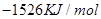题目内容
下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
①C4H10(g)+  O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol
②C4H10(g)+  O2(g)=4CO2(g)+5H2O(g) ΔH=-2658kJ/mol
O2(g)=4CO2(g)+5H2O(g) ΔH=-2658kJ/mol
③C4H10(g)+  O2(g)=4CO(g)+5H2O(l) ΔH=-1746kJ/mol
O2(g)=4CO(g)+5H2O(l) ΔH=-1746kJ/mol
④C4H10(g)+  O2(g)=4CO(g)+5H2O(g) ΔH=-1526kJ/mol
O2(g)=4CO(g)+5H2O(g) ΔH=-1526kJ/mol
由此判断,正丁烷的燃烧热是
| A.-2878kJ/mol | B.-2658kJ/mol |
| C.+1746kJ/mol | D.-1526 kJ/mo |
A
解析试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以①表示正丁烷燃烧热的热化学方程式,答案选A。
考点:考查燃烧热的判断
点评:在判断燃烧热时,需要注意的是“1mol”、“稳定的氧化物”。即H变成液态水,C变成CO2,S变成SO2等。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
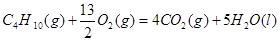
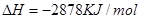

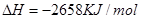
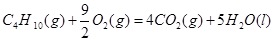
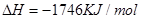
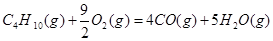
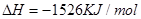
 B.
B. 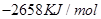 C.
C.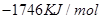 D.
D.