题目内容
常温时,将a mol Cu和a mol Fe投入含b mol HNO3的浓硝酸中,经一段时间后,使它们恰好完全反应。已知反应后溶液中Fe3+和Fe2+的物质的量相等,HNO3的还原产物为NO和NO2,且不考虑NO2转化为N2O4,反应中可产生气体560 mL。将该气体溶于水,充分反应后,气体体积减少224 mL(气体体积均为标准状况下体积)。求a、b的值。〔提示:已知2Fe(NO3)3+Fe====3Fe(NO3)2〕
a=0.01,b=0.07
常温下,将Fe和Cu投入浓硝酸中,由于Fe发生钝化,首先发生的反应为:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
待硝酸浓度降低后,随之发生的反应为:
Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
n(NO)+n(NO2)=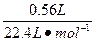 ="0.025" mol
="0.025" mol
由气体体积差量法:
3NO2+H2O====2HNO3+NO ΔV
3 mol 2×22.4 L
n(NO2) 0.224 L
n(NO2)="0.015" mol,n(NO)="0.025" mol-0.015 mol="0.01" mol。
据得失电子守恒:
2n(Cu2+)+2n(Fe2+)+3n(Fe3+)=3n(NO)+n(NO2)
2×a mol+2×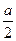 mol+3×
mol+3×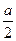 mol="3×0.01" mol+0.015 mol
mol="3×0.01" mol+0.015 mol
a=0.01
b的值可用两种方法求得:
解法一:反应消耗的HNO3:
n(HNO3)=2n(Cu2+)+2n(Fe2+)+3n(Fe3+)+n(NO)+n(NO2)="4.5" a mol+0.025 mol="4.5×0.01" mol+0.025 mol="0.07" mol
即b=0.07。
解法二:考察Fe、Cu与稀HNO3的3个反应,参加反应的HNO3的量均为被还原HNO3的量(即NO的量)的4倍,所以:
n(HNO3)=2n(NO2)+4n(NO)="2×0.015" mol+4×0.01 mol="0.07" mol
待硝酸浓度降低后,随之发生的反应为:
Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
n(NO)+n(NO2)=
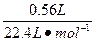 ="0.025" mol
="0.025" mol由气体体积差量法:
3NO2+H2O====2HNO3+NO ΔV
3 mol 2×22.4 L
n(NO2) 0.224 L
n(NO2)="0.015" mol,n(NO)="0.025" mol-0.015 mol="0.01" mol。
据得失电子守恒:
2n(Cu2+)+2n(Fe2+)+3n(Fe3+)=3n(NO)+n(NO2)
2×a mol+2×
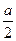 mol+3×
mol+3×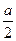 mol="3×0.01" mol+0.015 mol
mol="3×0.01" mol+0.015 mola=0.01
b的值可用两种方法求得:
解法一:反应消耗的HNO3:
n(HNO3)=2n(Cu2+)+2n(Fe2+)+3n(Fe3+)+n(NO)+n(NO2)="4.5" a mol+0.025 mol="4.5×0.01" mol+0.025 mol="0.07" mol
即b=0.07。
解法二:考察Fe、Cu与稀HNO3的3个反应,参加反应的HNO3的量均为被还原HNO3的量(即NO的量)的4倍,所以:
n(HNO3)=2n(NO2)+4n(NO)="2×0.015" mol+4×0.01 mol="0.07" mol

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

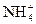 物质的量浓度相同的是( )
物质的量浓度相同的是( )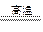 CO2+H2;N2+3H2
CO2+H2;N2+3H2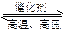 2NH3。根据化学方程式可知,理论上C与NH3的物质的量之比是( )
2NH3。根据化学方程式可知,理论上C与NH3的物质的量之比是( )