题目内容
(10分)某白色粉末可能含有K2SO4、NH4Cl、NaCl。请设计合理实验探究该白色粉末的组成。
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol?L-1硫酸、1mol?L-1硝酸、1mol?L-1盐酸、2mol?L-1NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
完成以下实验探究过程:
(1)提出假设:根据题意,该白色粉末的组成有______种可能的情况。
(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答)。
(3)根据(2)的实验方案,叙述实验操作、预期现象和结论。
实验操作 | 预期现象和结论 |
步骤1: |
|
步骤2: |
|
步骤3: |
|
步骤4: |
|
…… |
|
![]() (1) 7 (2分)
(1) 7 (2分)
![]() (3)
(3)
实验操作 | 预期现象和结论 |
步骤1:用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管。(1分) | 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl。(1分) |
步骤2:用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡。(1分) | 固体溶解得无色溶液。(1分) |
步骤3:向试管B中滴加过量的 Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置。(1分) | 有白色沉淀生成,证明原白色粉末含有 K2SO4。(1分) |
步骤4:取试管B中上层清液少量于试管C中,滴加 AgNO3溶液和1mol?L-1硝酸。(1分) | 有白色沉淀生成,证明原白色粉末含有NaCl。(1分) |
注:NH4Cl的检验用NaOH溶液和红色石蕊试纸同样得1分;另取样品溶于水进行K2SO4的检验同样得1分;NaCl的检验必须包含有上述4个步骤的操作,共4分(着重号为关键点);步骤设计不合理,次序混乱酌情扣分。

(17分)具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1) 草酸(H2C2O4)分解的化学方程式 为: ,
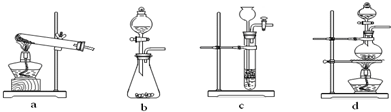
下列装置中,可用于草酸分解制取气体的是 。(填字母)
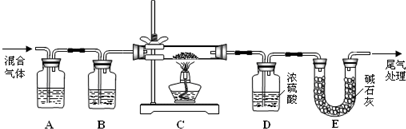
(2) 某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答:
① 为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
② 在点燃酒精灯之前应进行的操作是:(a) ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n= (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是 (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3) 该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | C/mol·l-1:] | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ |
| 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化剂对反应速率的影响 |
|
|
| 0.1 |
② 若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间。请你设计出
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案 。

 H2NCONHSO3H(s)
△H<0
H2NCONHSO3H(s)
△H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑

