题目内容
3.2g O2和0.2mol CO2物质的量之比为 ,原子数之比为 质量之比为 .
【答案】分析:根据n=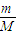 计算出O2的物质的量,然后求出比值;
计算出O2的物质的量,然后求出比值;
每个CO2分子含有3个原子,每个O2分子含有2个原子,根据N=nNA计算原子数目之比;
根据m=n×M求出CO2的质量,然后求出比值.
解答:解:O2的物质的量为 =0.1mol,3.2g O2和0.2mol CO2物质的量之比为:1:2;
=0.1mol,3.2g O2和0.2mol CO2物质的量之比为:1:2;
每个CO2分子含有3个原子,每个O2分子含有2个原子,0.1molO2和0.2mol CO2原子数目之比为:1:3;
CO2的质量为0.2mol×44g/mol=8.8g,质量之比为:4:11
故答案为:1:2;1:3;4:11.
点评:考查物质的量有关计算,难度不大,注意公式运用,尤其是分子中原子数目的求法.
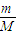 计算出O2的物质的量,然后求出比值;
计算出O2的物质的量,然后求出比值;每个CO2分子含有3个原子,每个O2分子含有2个原子,根据N=nNA计算原子数目之比;
根据m=n×M求出CO2的质量,然后求出比值.
解答:解:O2的物质的量为
 =0.1mol,3.2g O2和0.2mol CO2物质的量之比为:1:2;
=0.1mol,3.2g O2和0.2mol CO2物质的量之比为:1:2;每个CO2分子含有3个原子,每个O2分子含有2个原子,0.1molO2和0.2mol CO2原子数目之比为:1:3;
CO2的质量为0.2mol×44g/mol=8.8g,质量之比为:4:11
故答案为:1:2;1:3;4:11.
点评:考查物质的量有关计算,难度不大,注意公式运用,尤其是分子中原子数目的求法.

练习册系列答案
相关题目