题目内容
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.SPFS可表示成Fex(OH)y(SO4)z?nH2O.工业上常用的一种制备流程为:
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:
盐基度=
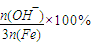 .式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量.
.式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量.试回答下列问题.
(1)取7.51g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g,向上述滤液中加入NH3?H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.80g.该固体聚合硫酸铁的盐基度为 .
(2)该固体聚合硫酸铁样品的化学式为 .
【答案】分析:(1)根据铁元素、硫酸根离子的守恒关系来确定含量,据已知信息计算盐基度;
(2)根据原子守恒和质量守恒来计算.
解答:解:(1)根据生成氧化铁的量可以计算得:n(Fe)= mol×2=0.035mol,取7.51g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g,即为硫酸钡沉淀的质量是10.48g,
mol×2=0.035mol,取7.51g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g,即为硫酸钡沉淀的质量是10.48g,
所以n(SO42-)= =0.045mol,所以n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol,
=0.045mol,所以n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol,
则盐基度= ×100%=
×100%= ×100%=14.29%,
×100%=14.29%,
故答案为:14.29%;
(2)根据质量守恒可以得出Fex(OH)y(SO4)z?nH2O中水的量n(H2O)=(7.51g-0.035mol×56g?mol-1-0.045mol×96 g?mol-1-0.015mol×17 g?mol-1)/18 g?mol-1=0.054mol,又知道:n(Fe)=0.035mol,n(OH-)=0.015mol,n(SO42-)=0.045mol,
化学式中各元素的物质的量之比等于其个数值比,即化学式:Fe35(OH)15(SO4)45?54H2O,
故答案为:Fe35(OH)15(SO4)45?54H2O.
点评:本题探究了固体聚合硫酸铁样品的组成,是一道计算知识的题目,考查学生分析和解决问题的能力,综合性较强,本题难度稍大.
(2)根据原子守恒和质量守恒来计算.
解答:解:(1)根据生成氧化铁的量可以计算得:n(Fe)=
 mol×2=0.035mol,取7.51g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g,即为硫酸钡沉淀的质量是10.48g,
mol×2=0.035mol,取7.51g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g,即为硫酸钡沉淀的质量是10.48g,所以n(SO42-)=
 =0.045mol,所以n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol,
=0.045mol,所以n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol,则盐基度=
 ×100%=
×100%= ×100%=14.29%,
×100%=14.29%,故答案为:14.29%;
(2)根据质量守恒可以得出Fex(OH)y(SO4)z?nH2O中水的量n(H2O)=(7.51g-0.035mol×56g?mol-1-0.045mol×96 g?mol-1-0.015mol×17 g?mol-1)/18 g?mol-1=0.054mol,又知道:n(Fe)=0.035mol,n(OH-)=0.015mol,n(SO42-)=0.045mol,
化学式中各元素的物质的量之比等于其个数值比,即化学式:Fe35(OH)15(SO4)45?54H2O,
故答案为:Fe35(OH)15(SO4)45?54H2O.
点评:本题探究了固体聚合硫酸铁样品的组成,是一道计算知识的题目,考查学生分析和解决问题的能力,综合性较强,本题难度稍大.

练习册系列答案
相关题目



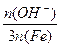 × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
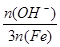 × 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题:
× 100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。请回答下列问题: