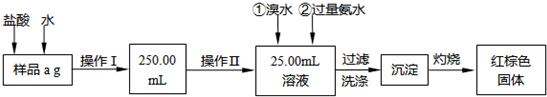
题目内容
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
(1)100 mL容量瓶、胶头滴管
(2)2Fe2++Cl2=2Fe3++2Cl-
(3)取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4) ×100% 固体加热时未充分反应变为Fe2O3
×100% 固体加热时未充分反应变为Fe2O3
【解析】(1)配制100 mL溶液,需用100 mL容量瓶,定容时使用胶头滴管;(2)氯气有强氧化性,能把二价铁离子氧化生成三价铁离子同时生成氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-。(3)检验沉淀已洗涤干净时,取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;(4)红棕色固体是氧化铁,其质量是W2 g-W1 g,其中铁元素的质量是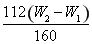 g,样品中铁元素的质量分数是
g,样品中铁元素的质量分数是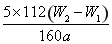 ×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
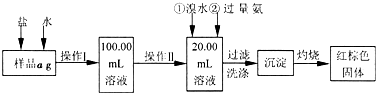
小学生10分钟应用题系列答案某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)