题目内容
为了证明醋酸是弱电解质,甲、乙、丙、三人分别选用下列试剂进行实验:
0.1 mol·L-1醋酸溶液、pH=3的盐酸、pH=3的醋酸、、蒸馏水、锌粒、pH试纸等。
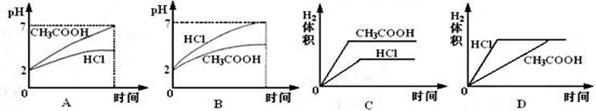
(1)甲取出10 mL0.1 mol·L-1醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是_________,理由是__________________________________。
(2)乙将pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,然后用pH试纸
分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是______________________________。
(3)丙分别取pH=3的盐酸和醋酸10 mL,然后分别加入质量相同的锌粒,醋酸放出H2的平均速率 (填“快”或“慢”),则认定醋酸是弱电解质,。
0.1 mol·L-1醋酸溶液、pH=3的盐酸、pH=3的醋酸、、蒸馏水、锌粒、pH试纸等。
(1)甲取出10 mL0.1 mol·L-1醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是_________,理由是__________________________________。
(2)乙将pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,然后用pH试纸
分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是______________________________。
(3)丙分别取pH=3的盐酸和醋酸10 mL,然后分别加入质量相同的锌粒,醋酸放出H2的平均速率 (填“快”或“慢”),则认定醋酸是弱电解质,。
(1) a>1 因为醋酸为弱酸部分电离 (2)盐酸的pH=5,醋酸的pH<5或醋酸在稀释过程中电离出H+,使PH变化小于盐酸。 (3)快
试题分析:醋酸是弱电解质,可测定一定浓度的pH、测定盐溶液的pH、醋酸的电离平衡移动、稀释时pH的变化等来分析;(1)测0.1 mol·L-1醋酸溶液的pH,若pH大于1,醋酸不能完全电离,则可证明醋酸为弱电解质;(2)pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,稀释100倍,测其pH,盐酸的pH变为5,若醋酸的pH<5,说明稀释促进醋酸电离,使H+浓度增大,证明醋酸溶液中存在电离平衡,为弱电解质;(3)当pH相同、体积相同时,盐酸完全电离,醋酸存在电离平衡,则分别加入足量锌,醋酸存在电离平衡向右移动,使得反应过程中醋酸中H+浓度大于盐酸,反应速率快。

练习册系列答案
相关题目
 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是 
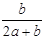 ×100%
×100%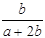 ×100%
×100%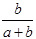 ×100%
×100%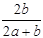 ×100%
×100%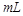
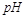 =2的醋酸溶液加水稀释到100
=2的醋酸溶液加水稀释到100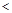 3
3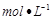 醋酸溶液,需要消耗0.1
醋酸溶液,需要消耗0.1