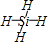题目内容
(11分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子
式分别是 、 ;杂化轨道分别是 、 ;a分子的
立体结构是 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、
晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式) 。
(4)Y与Z比较,电负性较大的是 。
(5)W的元素符号是 ,其+2价离子的核外电子排布式是 。
【答案】
(1)CH4 SiH4 sp3 sp3 正四面体
(2)分子 原子 (3)CO2
(4)C (5)Zn 1s22s22p63s23p63d10
【解析】略

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目