题目内容
在25℃时,向100mL含氯化氢14.6g的盐酸里,放入5.6g铁粉(不考虑反应前后溶液体积的
变化),反应开始到2min末收集到H2 1.12L(标准状况),在此后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2 表示的平均反应速率是多少?
(2)在后4min内用HCl表示的 平均反应速率是多少?
(3)前2min与后4min相比,反应速率哪个较快?为什么?
变化),反应开始到2min末收集到H2 1.12L(标准状况),在此后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2 表示的平均反应速率是多少?
(2)在后4min内用HCl表示的 平均反应速率是多少?
(3)前2min与后4min相比,反应速率哪个较快?为什么?
(1) 0.25mol·(L·min)—1 、 (2)0.25 mol·(L·min)—1
(3)2min 反应速率快。因为反应物浓度减小,反应速率减慢。
(3)2min 反应速率快。因为反应物浓度减小,反应速率减慢。
试题分析:(1)反应开始到2min末收集到H2 1.12L(标准状况)
则氢气的物质的量是1.12L÷22.4L/mol=0.05mol
因此生成0.05mol氯化亚铁
所以在前2min内用FeCl2 表示的平均反应速率是
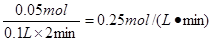
(2)铁的物质的量是5.6g÷56g/mol=0.1mol
在前2min内消耗铁是0.05mol
所以后4min内消耗铁是0.1mol-0.05mol=0.05mol
所以消耗氯化氢的物质的量是0.05mol×2=0.1mol
则在后4min内用HCl表示的平均反应速率是
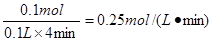
(3)因为反应物浓度减小,反应速率减慢,所以前2min与后4min相比,2min 反应速率快。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。主要是考查学生对反应速率概念以及有关计算的熟悉掌握程度,有利于培养学生的规范答题能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目
 2NO2(g)不能说明已达到平衡状态的是
2NO2(g)不能说明已达到平衡状态的是 
 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( ) pC(g)+qD(g)的v-t图象如图,如若其它条件不变,只是在反应前加入合适的催化剂,其v-t图象如图。:则
pC(g)+qD(g)的v-t图象如图,如若其它条件不变,只是在反应前加入合适的催化剂,其v-t图象如图。:则