题目内容
设NA为阿伏加德罗常数的值.下列叙述中正确的是( )A.11.2L的NO气体中含有的原子总数为NA
B.标准状况下,22.4LSO2中所含分子数为NA
C.0.5L1mol?L-1的Na2SO4溶液中,阴阳离子总数为NA
D.12g金属镁变为镁离子时失去的电子数为NA
【答案】分析:A、气体摩尔体积22.4L/mol使用条件为标准状况;
B、根据n=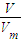 计算二氧化硫的物质的量,再根据N=nNA计算二氧化硫分子数目;
计算二氧化硫的物质的量,再根据N=nNA计算二氧化硫分子数目;
C、根据n=cV计算硫酸钠的物质的量,结合化学式再根据N=nNA计算阴阳离子数目;
D、根据m=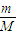 计算镁的物质的量,再根据N=nNA计算镁失去的电子数目.
计算镁的物质的量,再根据N=nNA计算镁失去的电子数目.
解答:解:A、NO不一定处于标准状况,不能使用气体摩尔体积22.4L/mol,故A错误;
B、标准状况下,22.4LSO2的物质的量为1mol,含有NA个SO2分子,故B正确;
C、0.5L1mol?L-1的Na2SO4溶液中,阴阳离子总数为0.5L×1mol?L-1×3×NAmol-1=1.5NA,故C错误;
D、1个镁原子失去2个电子形成镁离子,12g金属镁变为镁离子时失去的电子数为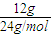 ×2×NAmol-1=NA,故D正确.
×2×NAmol-1=NA,故D正确.
故选BD.
点评:本题考查常用化学计量数的有关计算,难度不大,注意气体摩尔体积的使用条件与对象.
B、根据n=
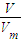 计算二氧化硫的物质的量,再根据N=nNA计算二氧化硫分子数目;
计算二氧化硫的物质的量,再根据N=nNA计算二氧化硫分子数目;C、根据n=cV计算硫酸钠的物质的量,结合化学式再根据N=nNA计算阴阳离子数目;
D、根据m=
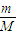 计算镁的物质的量,再根据N=nNA计算镁失去的电子数目.
计算镁的物质的量,再根据N=nNA计算镁失去的电子数目.解答:解:A、NO不一定处于标准状况,不能使用气体摩尔体积22.4L/mol,故A错误;
B、标准状况下,22.4LSO2的物质的量为1mol,含有NA个SO2分子,故B正确;
C、0.5L1mol?L-1的Na2SO4溶液中,阴阳离子总数为0.5L×1mol?L-1×3×NAmol-1=1.5NA,故C错误;
D、1个镁原子失去2个电子形成镁离子,12g金属镁变为镁离子时失去的电子数为
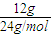 ×2×NAmol-1=NA,故D正确.
×2×NAmol-1=NA,故D正确.故选BD.
点评:本题考查常用化学计量数的有关计算,难度不大,注意气体摩尔体积的使用条件与对象.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
设NA为阿伏加德罗常数值,下列说法不正确的是
| A.1 mol O2与金属钠反应,O2不一定得到4NA个电子 |
| B.标准状况下,a L CH4和a L C6H14中所含分子数均为a NA/22.4 |
| C.常温常压下,1 mol氯气与足量的金属镁反应,转移2NA个电子 |
| D.在20 ℃、1.01×105 Pa时,2.8 g C2H4和CO的混合气体含气体分子数等于0.1 NA |