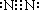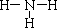题目内容
在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4。
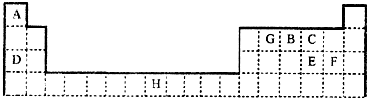
(1)画出D的原子结构示意图________,五种元素原子半径从大到小的顺序是________(填元素符号)。
(2)A与B形成的化合物中,含非极性键的化合物的结构式为 。
(3)C与B按原子个数比为1:1形成化合物的电子式是 。
(4)D、E所形成氢化物的稳定性由强到弱的顺序是 、 (填具体的化学式)。
(5)由短周期元素组成的某些微粒,如SO2、O3、NO2-可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-.CS2互称为等电子体的微粒是 (填符合要求所有微粒的名称)。
(6)写出工业上制E单质的化学方程式 。
(15分,每空2分)答案:(1)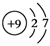 Na、Si、O、F、H
Na、Si、O、F、H
(2)H—O—O—H
(3)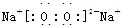
(4)HF、SiH4 (5)二氧化碳、一氧化二氮、二氟化铍(3分)
(6)2C+SiO2 Si+2CO↑
Si+2CO↑
【解析】
试题分析:根据“在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物。”得出:A为H , C 为Na,B为O ,又根据“D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4,”说明E是ⅣA,核电荷数最大,所以是硅,D是F。
⑴D是氟元素,原子结构示意图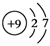 ,同一周期从左到右原子半径由大到小,所以Na>Si,O>F,H最小,原子半径从大到小的顺序是Na、Si、O、F、H,答案:
,同一周期从左到右原子半径由大到小,所以Na>Si,O>F,H最小,原子半径从大到小的顺序是Na、Si、O、F、H,答案: 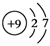 Na、Si、O、F、H;⑵A与B形成的化合物有H2O、H2O2,含非极性键的化合物是H2O2,结构式为H—O—O—H,答案:H—O—O—H;⑶C与B按原子个数比为1:1形成化合物是Na2O2,电子式是
Na、Si、O、F、H;⑵A与B形成的化合物有H2O、H2O2,含非极性键的化合物是H2O2,结构式为H—O—O—H,答案:H—O—O—H;⑶C与B按原子个数比为1:1形成化合物是Na2O2,电子式是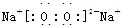 ,答案:
,答案: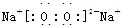 ;⑷F的电负性大于Si,氢化物的稳定性强,答案:HF、SiH4 ;⑸与B、D同周期元素组成的微粒中,能与N3-.CS2互称为等电子体的微粒是N2O,、CO2、BeF2,答案:二氧化碳、一氧化二氮、二氟化铍;⑹工业上制粗硅的方程式为:2C+SiO2
;⑷F的电负性大于Si,氢化物的稳定性强,答案:HF、SiH4 ;⑸与B、D同周期元素组成的微粒中,能与N3-.CS2互称为等电子体的微粒是N2O,、CO2、BeF2,答案:二氧化碳、一氧化二氮、二氟化铍;⑹工业上制粗硅的方程式为:2C+SiO2 Si+2CO↑ ,答案:2C+SiO2
Si+2CO↑ ,答案:2C+SiO2 Si+2CO↑
Si+2CO↑
考点:原子结构与元素周期率的关系,元素及其化合物的性质

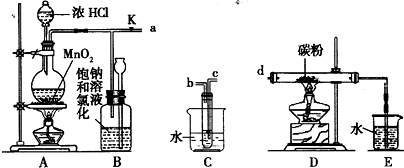
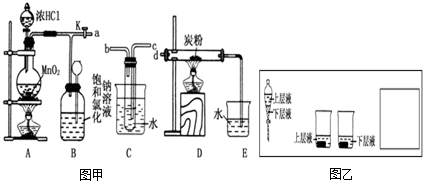
 如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置.