题目内容
抗击“非典”期间,过氧乙酸(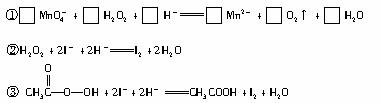
④I2+2S2O![]()
![]() S4O
S4O![]() +2I-?
+2I-?
请完成以下问题:?
(1)配平反应①的离子方程式(配平计量数填入以下方框内):?
![]()
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是? ?。?
(3)取b0 mL 待测液,用硫酸使溶液酸化,再用浓度为?a1 mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为?b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为a2 mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为?b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。?
c0=? ???。?
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果? ?(填“是”或“否”)。
(1)2 5 6 2 5 8?
(2)淀粉溶液 (3)![]() ? (4)否?
? (4)否?
解析:(1)根据电子得失守恒和电荷守恒关系可迅速解答。(2)检验淀粉溶液用碘水。(3)由以上离子方程式可知:n(CH3COOOH) +n(H2O2)=1/2n(S2O![]() )=1/2a2b2,n(H2O2)=2.5n(MnO
)=1/2a2b2,n(H2O2)=2.5n(MnO![]() )=2.5a1b1,解得n(CH3COOOH)。(4)加入过量的KI溶液的目的是使过氧乙酸和双氧水全部反应,在进行计算时与KI的量无关。
)=2.5a1b1,解得n(CH3COOOH)。(4)加入过量的KI溶液的目的是使过氧乙酸和双氧水全部反应,在进行计算时与KI的量无关。

练习册系列答案
相关题目

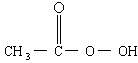 是广为使用的消毒剂.它可由
是广为使用的消毒剂.它可由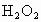 和冰醋酸反应制取,所以在过氧乙酸中常含有残留的
和冰醋酸反应制取,所以在过氧乙酸中常含有残留的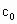 .涉及下列反应:
.涉及下列反应: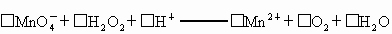
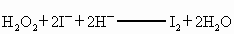
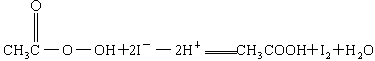


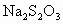 标准溶液滴定
标准溶液滴定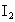 时(反应④)选用的指示剂是__________.
时(反应④)选用的指示剂是__________.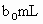 待测液,用硫酸使溶液酸化,再用浓度为
待测液,用硫酸使溶液酸化,再用浓度为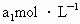 标准溶液滴定其中的
标准溶液滴定其中的 体积为
体积为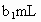 (反应①,滴定过程中
(反应①,滴定过程中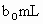 待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的
待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的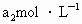 的
的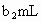 .
.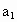 、
、 、
、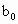 、
、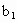 、
、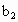 的代数式表示).
的代数式表示).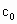 =__________.
=__________.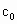 ,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”).
,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”). )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应: +2H+ ═ I2+2H2O
+2H+ ═ I2+2H2O
 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·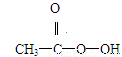 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应: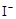 +2H+ = I2+2H2O
+2H+ = I2+2H2O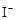 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O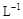 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。