题目内容
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,(已知pH=-lgc(H+))下列叙述错误的是:
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
【答案】
B
【解析】
HA
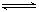 H+
+ A-
H+
+ A-
C0 0.1 0 0
△C 0.1×0.1% 1×10-4 1×10-4
C(平衡)0.1×(1-0.1%) 1×10-4 1×10-4
升高温度,平衡正向移动,C(H+)增大,PH值减小,故B错误;
C(H+)= 1×10-4,则PH=4,故A正确;
K=[(1×10-4)×(1×10-4)]/[ 0.1×(1-0.1%)]= 1×10-7,故C正确;
利用Kw= C(H+)C(OH-),得:C水(OH-)=1×10-10= C水(H+),所以:HA电离出的c(H+)=1×10-4, C水(H+)=1×10-10,故D正确

练习册系列答案
相关题目
 B.升高温度,溶液的pH增大
B.升高温度,溶液的pH增大