题目内容
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g 的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是______________,其相应的质量为________。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH=________。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:________________。
命题意图:本题以磷为载体,考查燃烧热、盖斯定律及热化学方程式的有关知识,重点是考查燃烧热定义和盖斯定律的理解和应用,而涉及磷的知识并不复杂。
(1)P2O3和P2O5 2.75 g和3.55 g
(2)-(20X-Y) kJ·mol-1
(3)P(s)+![]() O2(g)====
O2(g)====![]() P2O3(s);ΔH=-(20X-Y) kJ·mol-1
P2O3(s);ΔH=-(20X-Y) kJ·mol-1
解析:
(1)由题意得生成的两种氧化物分别为P2O3和P2O5,设生成P2O3和P2O5需P的物质的量分别为x、y,根据反应方程式:4P+3O2====2P2O3和4P+5O2====2P2O5得
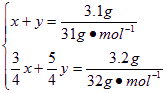
解得x=y=0.05 mol。
(2)由燃烧热的定义,推出0.05 mol磷单质完全燃烧放出的热量为0.05 Y kJ,则生成P2O3时放出的热量为(X-0.05Y)kJ,从而推出1 mol磷单质燃烧生成P2O3时放出的热量为![]() (X-0.05Y)kJ,即(20X-Y)kJ。
(X-0.05Y)kJ,即(20X-Y)kJ。

练习册系列答案
相关题目
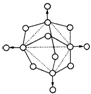 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)