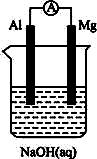
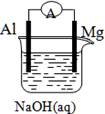
题目内容
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、用电器连接成原电池,此电池工作时,下列叙述中正确的是( )?
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+?
B.负极反应式为:Al-3e-+4OH-![]()
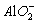 +2H2O?
+2H2O?
C.该电池的内外电路中,电流均是由电子定向移动形成的?
D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出?
解析:由于金属铝能够和NaOH溶液发生反应而镁不能,故还原剂为金属镁而不是金属铝,负极反应:Al-3e-+4OH-![]() AlO
AlO![]() +2H2O,B选项正确。该电池的外电路中,电流是由电子的定向移动形成的,内电路是由阴、阳离子的定向移动形成的。金属铝作为电池的正极,发生还原反应,作阴极,但该过程不产生沉淀。?
+2H2O,B选项正确。该电池的外电路中,电流是由电子的定向移动形成的,内电路是由阴、阳离子的定向移动形成的。金属铝作为电池的正极,发生还原反应,作阴极,但该过程不产生沉淀。?
答案:B

练习册系列答案
相关题目
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是 
| A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+ |
| B.负极反应式为:Al+4OH--3e-=AlO2-+2H2O |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出 |
 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池.此电池工作时,下列叙述中正确的是( )
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池.此电池工作时,下列叙述中正确的是( )