题目内容
在T℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| t1min时,达到平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、若升高温度,该反应的平衡常数增大,则该反应是放热反应 |
| B、反应达到平衡时,X的转化率为50% |
| C、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| D、其它条件不变,若把此容器压缩一半,达到平衡时Y的浓度大于0.05mol?L-1,小于0.1mol?L-1 |
分析:A、根据反应的平衡常数和温度以及反应吸放热之间的关系来回答;
B、根据转化率=
×100%计算;
C、根据反应速率之比等于化学计量数之比判断化学方程式,根据平衡常数表达式计算平衡常数;
D、依据化学方程式反应前后的气体体积变化情况,结合压强对化学平衡移动的影响来分析判断.
B、根据转化率=
| 浓度变化量 |
| 浓度初始量 |
C、根据反应速率之比等于化学计量数之比判断化学方程式,根据平衡常数表达式计算平衡常数;
D、依据化学方程式反应前后的气体体积变化情况,结合压强对化学平衡移动的影响来分析判断.
解答:解:A、如果反应是放热反应,升高温度,该反应的平衡常数减小,故A错误;
B、反应达到平衡时,X的转化率为:
×100%=50%,故B正确;
C、根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,则反应的方程式为X+3Y?2Z,K═
=1600,故C正确;
D、反应X+3Y?2Z正向是气体体积减小的反应,其它条件不变,若把此容器压缩一半,即浓度要变为原来的一倍,但是增大压强平衡向正反应方向移动,即向着生成Z的方向移动达到平衡时Y的浓度大于0.05mol?L-1,小于0.1mol?L-1,故D正确;
故选:A.
B、反应达到平衡时,X的转化率为:
| 0.1-0.05 |
| 0.1 |
C、根据反应速率之比等于浓度变化量之比等于化学计量数之比可知:△c(X):△c(Y):△c(Z):=0.05:0.15:0.1=1:3:2,则反应的方程式为X+3Y?2Z,K═
| 0.12 |
| 0.05×0.053 |
D、反应X+3Y?2Z正向是气体体积减小的反应,其它条件不变,若把此容器压缩一半,即浓度要变为原来的一倍,但是增大压强平衡向正反应方向移动,即向着生成Z的方向移动达到平衡时Y的浓度大于0.05mol?L-1,小于0.1mol?L-1,故D正确;
故选:A.
点评:本题考查了化学平衡的有关计算,化学方程式的书写方法,化学平衡常数的计算,影响化学平衡的因素分析判断,题目难度中等,书写方程式是解题关键.

练习册系列答案
相关题目
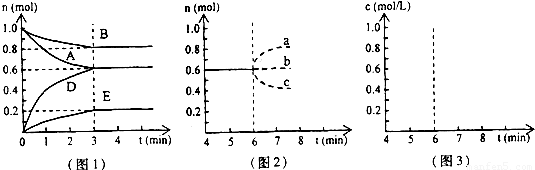
(12分) 在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:
 |
mA(g)+nB(g)
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3) 下列措施能增大B的转化率的是
A.再投入2molA和1molB B.保持体积不变通入1molB
C.移出部分物质D D.再投入2molA、1molB和0.6molD
(4) 在T℃时,相同容器中,若开始时加入0.2 mol A 、0.8 mol B 、0.9 mol D 、0.5 mol E反应,达到平衡后,A的浓度 0.2mol/L(填“大于”、“小于”、“等于”)理由是
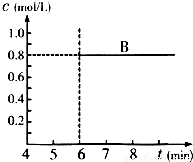
(5) 反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度 (用虚线)
②若将容器的容积压缩为原来一半(用实线)

 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).

 N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______
N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______