题目内容
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
【答案】
(1)25% 20%
(2)a+c/2=2,b+3c/2=4
(3)碱性 O2+2H2O+4e-=4OH-
【解析】
试题分析:(1)根据化学方程式可知消耗了0.5mol的氮气,所以氮气的转化率为25%,氨气的体积分数为1/(1.5+2.5+1)=20%;
(2)等效平衡;
(3)氨气溶于水容易与酸性溶液或中性溶液中的氢离子发生化学反应。
考点:化学平衡和燃料电池。

练习册系列答案
相关题目

 CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1 CH3OCH3(g)+CO2(g),则该反应的△H =
CH3OCH3(g)+CO2(g),则该反应的△H = 
 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
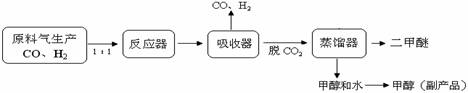
 CH3OH(g) △H =
—90.7kJ·mol—1
CH3OH(g) △H =
—90.7kJ·mol—1 CH3OCH3(g)+CO2(g),则该反应的△H
=
CH3OCH3(g)+CO2(g),则该反应的△H
=

 ,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
 、
、 此时正、逆反应速率的大小:
此时正、逆反应速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
 NO(g)+SO3(g)
NO(g)+SO3(g)  _______,
_______, ________,而c(NO)与c(NO2)之和
________,而c(NO)与c(NO2)之和