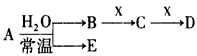题目内容
| |||||||||||||||||||||||
解析:
(4) |
|
(5) |
H2(g)+1/2O2(g)=H2O(g);△H=-285.8kJ/mol |

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑨ | ⑦ | ⑧ | |
Ⅰ、(1)元素⑦中质子数和中子数相等的原子符号是________________。
(2)④、⑤两种元素原子按1:1组成的常见化合物的化学式________________。
(3)③、⑧和⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是________________。
(4)用电子式表示①和⑤形成化合物的过程_________________________。
Ⅱ、由表中元素形成的物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧化性单质,则A不可能是______________
a、S b、N2 c、Na d、Mg e、Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是____________________________________
__________________________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:___________________________________________。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键 B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。已知晶胞边长为bcm,阿伏伽德罗常数为NA该氧化物的密度为__________________g/cm-3

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
⑨ |
⑦ |
⑧ |
|
根据元素在周期表中的位置可知,①~⑨分别是H、C、N、O、Na、Al、S、Cl、P。
Ⅰ、(1)元素⑦中质子数和中子数相等的原子符号是________________。
(2)④、⑤两种元素原子按1:1组成的常见化合物的化学式________________。
(3)③、⑧和⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是________________。
(4)用电子式表示①和⑤形成化合物的过程_________________________。
Ⅱ、由表中元素形成的物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧化性单质,则A不可能是______________
a、S b、N2 c、Na d、Mg e、Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是____________________________________
__________________________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:___________________________________________。