题目内容
(2010?诸城市模拟)室温下,0.1mol?L-1某一元碱酸(AOH)溶液中
=1×10-8,下列叙述不正确的是( )
| c(OH-) |
| c(H+) |
分析:0.1mol?L-1某一元碱(AOH)溶液中c(OH-)/c(H+)=1.0×108,则c(OH-)=10-11mol/L,c(H+)=1.0×10-3mol/L,
A、根据氢离子浓度来计算溶液的pH;
B、根据水的离子积常数表达式结合水电离产生的氢离子和氢氧根离子浓度相等来回答;
C、根据水的离子积常数和温度的关系来回答;
D、盐酸和弱碱恰好完全反应生成的是强酸弱碱盐,溶液显示酸性.
A、根据氢离子浓度来计算溶液的pH;
B、根据水的离子积常数表达式结合水电离产生的氢离子和氢氧根离子浓度相等来回答;
C、根据水的离子积常数和温度的关系来回答;
D、盐酸和弱碱恰好完全反应生成的是强酸弱碱盐,溶液显示酸性.
解答:解:0.1mol?L-1某一元碱(AOH)溶液中c(OH-)/c(H+)=1.0×108,则c(OH-)=10-3mol/L,c(H+)=1.0×10-11mol/L,
A、一元碱(AOH)溶液中,氢离子浓度为1.0×10-11mol/L,可得溶液的pH为11,故A正确;
B、水电离产生的氢离子和氢氧根离子浓度相等,该溶液中由水电离出的c(OH-)=1.0×10-11mol?L-1,故B正确;
C、室温下,水的离子积常数为1.0×10-14mol2?L-2,故C正确;
D、由于氨水是弱碱,电离程度很小,反应后溶液总还存在大量的氨水,使氨水的电离大于铵根离子的水解,溶液呈碱性,因此要使溶液呈中性,必须使加入的盐酸的体积要大一些,所以V1>V2,故D错误.
故选D.
A、一元碱(AOH)溶液中,氢离子浓度为1.0×10-11mol/L,可得溶液的pH为11,故A正确;
B、水电离产生的氢离子和氢氧根离子浓度相等,该溶液中由水电离出的c(OH-)=1.0×10-11mol?L-1,故B正确;
C、室温下,水的离子积常数为1.0×10-14mol2?L-2,故C正确;
D、由于氨水是弱碱,电离程度很小,反应后溶液总还存在大量的氨水,使氨水的电离大于铵根离子的水解,溶液呈碱性,因此要使溶液呈中性,必须使加入的盐酸的体积要大一些,所以V1>V2,故D错误.
故选D.
点评:本题是一道关于弱电解质的电离平衡以及溶液pH计算的综合题,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
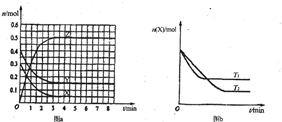 (2010?诸城市模拟)T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )
(2010?诸城市模拟)T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )


