题目内容
(2011?四川二模)常温下,将200mL pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间后,测得溶液的PH变为b(溶液体积的变化忽略不计),在聱个电解过程中始终只有一个电极上有气体产生.下列说法错误的是( )
分析:根据题意分析,在聱个电解过程中始终只有一个电极上有气体产生,所以电解池工作时,阳极上氢氧根离子放电,生成氧气;阴极上铜离子得电子生成铜单质,所以电池反应式为
2CuSO4+2H2O
2H2SO4+2Cu+O2↑,电解后生成硫酸的物质的量=(10-b-10-a)mol/L×0.2L=0.2(10-b-10-a)mol.
2CuSO4+2H2O
| ||
解答:解:A、要使溶液恢复到原来的浓度,应向电解后的溶液中加入电解时析出的物质,即氧化铜,不是氢氧化铜,故A错误;
B、电解时,阳极上氢氧根离子放电,阴极上铜离子放电,所以导致溶液中氢离子浓度越来越大,溶液的PH值越来越小,即b<a<7,故B正确;
C、阳极上产生的气体是氧气,根据电池反应式计算氧气的体积.
设生成氧气的体积为V.
2CuSO4+2H2O
2H2SO4+2Cu+O2↑,
2mol 22.4L
0.2(10-b-10-a)mol V
V=2.24(10-b-10-a)L.
故C错误;
D、电解时,阴极上溶液中铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D正确.
故选AC.
B、电解时,阳极上氢氧根离子放电,阴极上铜离子放电,所以导致溶液中氢离子浓度越来越大,溶液的PH值越来越小,即b<a<7,故B正确;
C、阳极上产生的气体是氧气,根据电池反应式计算氧气的体积.
设生成氧气的体积为V.
2CuSO4+2H2O
| ||
2mol 22.4L
0.2(10-b-10-a)mol V
V=2.24(10-b-10-a)L.
故C错误;
D、电解时,阴极上溶液中铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D正确.
故选AC.
点评:本题以电解原理为载体考查了氧化还原反应的有关计算,难度较大,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
 (其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.
(其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.





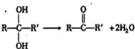 ,对于某有机物
,对于某有机物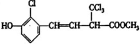 下列说法正确的是( )
下列说法正确的是( )